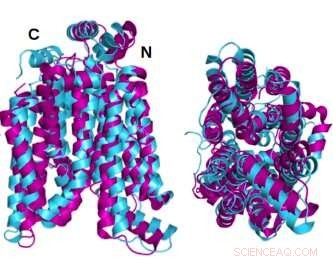
Två vinklar av den kristallina strukturen GLUT1 (magenta) glukostransportörprotein överlagrat med AlphaFold2 datorförutspådda vattenlösliga variant av samma protein (cyan) visar att det kristallina proteinet och dess vattenlösliga QTY-variant delar anmärkningsvärd strukturell likhet. Kredit:Shuguang Zhang Laboratory, MIT
Alla cellmembran i människokroppen har inbäddade proteiner som fungerar som sensorer, budbärare eller som ett sätt att transportera och reglera ämnen som går in och ut ur cellen. Speciellt transportproteiner är dåligt förstådda på grund av deras strukturella komplexitet och deras hydrofoba natur som gör dem resistenta mot studier. Samtidigt spelar dessa transportproteiner, särskilt de som reglerar glukos, en avgörande roll i tillväxten av cancertumörer.
I en ny studie visade forskare under ledning av Dr Shuguang Zhang, Ph.D. från MIT Media Lab, visar en metod för att snabbt förutsäga utformningen av hydrofila variantstrukturer av de 14 glukostransportmembranproteinerna i celler. Detta gör det möjligt för forskare att lättare studera proteinerna i vatten. Forskarna bekräftar noggrannheten hos de förutsagda strukturerna genom att jämföra dem med redan existerande kristallografiska bilder av två av proteinerna.
De hoppas att en ökad förståelse för dessa glukostransportproteiner kommer att påskynda utvecklingen av terapeutiska monoklonala antikroppar för att behandla cancermetastaser. Detta skulle i huvudsak svälta cancerceller genom att blockera glukostransportörer.
"De flesta cancerceller ökar avsevärt deras uttryck och produktion av glukostransportörer, kallade GLUTs, för deras omättliga energibehov", säger Eva Smorodina, en undergraduate intern-student i strukturell biologi vid Greiff Lab, Universitetet i Oslo, som är första författare till en artikel om studien publicerad 27 juni i QRB Discovery . "För närvarande finns det nästan inga effektiva läkemedel för att blockera GLUT, eftersom de har en utmanande struktur."
GLUTs komplexa strukturer omfattar 12 transmembrana hydrofoba helixar inbäddade i membranet. I sitt ursprungliga eller kristallina tillstånd måste de hydrofoba strukturerna placeras i ett speciellt tvättmedel eller reagens för laboratoriestudier, annars förlorar de sin struktur. Och med proteiner är struktur och funktion outplånligt relaterade.
"Att studera dessa proteiner i tvättmedel är som att bära tunga handskar för att montera en dyr klocka eller spela fiol", säger Dr Zhang, en av de få biomedicinska forskare för vilka studiet av membranproteiner är lika övertygande som det är avgörande för vår förståelse av cancerceller. Han började arbeta med membranproteiner i början av 2000-talet. "Få människor studerade dessa membranproteiner", säger Dr Zhang. "De är som en het potatis", säger han, på grund av deras inneboende motstånd mot studier.
Det nya arbetet är baserat på Dr. Zhangs framgång för fyra år sedan, när han och ett team åstadkom det som Dr. Zhang hade arbetat med i nästan ett decennium:De designade en vackert enkel metod som kallas QTY-koden för att transformera ett hydrofobt cellmembranprotein. till ett hydrofilt protein genom att ersätta många hydrofoba aminosyror.
QTY-koden är uppkallad efter symbolerna för de tre aminosyrorna – glutamin (Q), treonin (T) och tyrosin (Y) – som ersätter fyra hydrofoba aminosyror:leucin (L), isoleucin (I), valin ( V) och fenylalanin (F). Ingen av dessa aminosyror har en laddning, vilket gör substitutionen godartad. Strukturen är avgörande för proteinernas funktion, och substitutionen förändrar inte strukturen.
I den senaste studien tillämpar Dr Zhang och teamet QTY-koden på de 14 glukostransportmembranproteinerna som transporterar socker till celler. De använde det nya AlphaFold2-programmet, ett artificiell intelligensbaserat beräkningsprogram utvecklat av företaget DeepMind, som exakt och snabbt kan förutsäga hur proteiner vikas. Dr. Zhang och team använde QTY-koden med öppen källkod AlphaFold2 för att förutsäga alfaspiralformerna för de 14 GLUT-proteinerna i både deras naturliga hydrofoba former och deras QTY-kod förändrade vattenlösliga former.
De kristallina eller naturliga tillståndsstrukturerna för två av GLUT-1 och 3-hade avslöjats tidigare av andra forskare som använde röntgenkristallografi. För att underbygga sin egen metodik förutspådde Dr. Zhangs team först den hydrofila strukturen av dessa två GLUT genom att tillämpa QTY-kodens aminosyraersättningar och låta AlphaFold2 förutsäga proteinernas former. Det gjorde det med stor noggrannhet. De överlagrade hydrofoba och hydrofila bilderna är nästan identiska.
Teamet följde upp denna bekräftelse genom att kombinera QTY-kod och AlphaFold2 för att förutsäga de hydrofila strukturerna för de 12 andra GLUTerna – på rekordtid. "Under 2018 tog det fyra till fem veckor att använda ett höghastighetsdatorkluster för att simulera vilken proteinstruktur som helst", säger Dr Zhang. "Nu med AlphaFold2 kan vi använda en Google-dator gratis, och den simulerar transmembranproteinerna i timmar. Vissa små proteiner tog mindre än en timme."
"Denna studie på mänskliga membranglukostransportörer och deras vattenlösliga QTY-varianter från Zhang-laboratoriet vid MIT är fascinerande", säger professor Joel Sussman vid Weizmann Institute of Science i Rehovot, Israel, som inte var involverad i arbetet. "Det ger experimentell visualisering via röntgenkristallografi och AI-förutsägelse med hjälp av AlphaFold2 för att för första gången, vid atomupplösning, se skillnaderna mellan hydrofoba "vattenhatande" helixar och hydrofila "vattenälskande" helixar. Det är en kritisk steg i att använda QTY-kodmetoden för att studera multispan-transmembranproteiner och andra aggregerade proteiner genom deras vattenlösliga varianter, och kommer sannolikt att ha en enorm inverkan inom bioteknikområdet."
Professor Robert Langer vid MIT, vars arbete inom biomedicinsk teknik är mycket hyllad, säger:"[QRB Discovery ] papper är utmärkt, och jag tror har potentialen att hjälpa många cancerpatienter." Professor Langer var inte involverad i forskningen.
Författare till QRB Discovery papper är Dr Zhang och Smorodina; Fei Tao och Rui Qing från Shanghai Jiaotong University (Dr. Qing var tidigare postdoktor vid MIT Media Lab och senare forskare vid Koch Institute for Integrative Cancer Research vid MIT); Dr. Steve Yang en MIT-alumn nu vid PT Metiska Farma i Indonesien; och Dr. David Jin, M.D., Ph.D. av Avalon GloboCare Corp., som stimulerade Dr. Zhang att tillämpa QTY-koden för studier av cancerceller. Avalon GloboCare finansierade också forskningen.
Dr Jin säger att han hoppas – men detta är inte en del av den aktuella studien – att framtida forskning kommer att kunna genetiskt förändra glukospassagemembranen för att utveckla nya terapeutiska mål.
"Nu är våra enda val för cancerbehandling kirurgi, kemoterapi eller småmolekylär terapi", säger Dr Jin. "I framtiden kan det vara möjligt att ta en patients T-cell, en komponent i immunsystemet, och genetiskt modifiera den i labbet så att den kan fungera nästan som ett cancersökande GPS-system med en tumörattackerande förmåga. " + Utforska vidare