Dimerisering av spikprotein med "tvåsidig peptid". Kredit:Bhavesh Khatri
Den snabba uppkomsten av nya stammar av SARS-CoV-2-viruset har minskat skyddet som erbjuds av covid-19-vacciner. En ny metod utvecklad av forskare vid Indian Institute of Science (IISc) ger nu en alternativ mekanism för att göra virus som SARS-CoV-2 inaktiva.
I en studie publicerad i Nature Chemical Biology , rapporterar forskarna utformningen av en ny klass av konstgjorda peptider eller miniproteiner som inte bara kan blockera virusinträde i våra celler utan också klumpar ihop virioner (viruspartiklar), vilket minskar deras förmåga att infektera.
En interaktion mellan protein och protein är ofta som ett lås och en nyckel. Denna interaktion kan hämmas av ett labbtillverkat miniprotein som härmar, konkurrerar med och förhindrar "nyckeln" från att binda till "låset" eller vice versa.
I den nya studien har teamet utnyttjat detta tillvägagångssätt för att designa miniproteiner som kan binda till och blockera spikeproteinet på ytan av SARS-CoV-2-viruset. Denna bindning karakteriserades ytterligare omfattande genom kryo-elektronmikroskopi (kryo-EM) och andra biofysiska metoder.
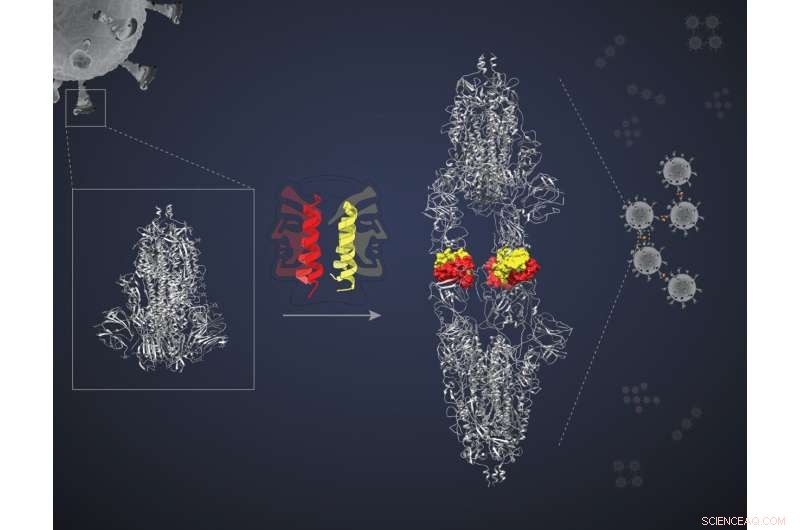
Dessa miniproteiner är spiralformade, hårnålsformade peptider, som var och en kan paras ihop med en annan i sitt slag och bilda vad som kallas en dimer. Varje dimerisk "bunt" presenterar två "ansikten" för att interagera med två målmolekyler. Forskarna antog att de två ansiktena skulle binda till två separata målproteiner som låser alla fyra i ett komplex och blockerar målens verkan. "Men vi behövde bevis på principen", säger Jayanta Chatterjee, docent vid Molecular Biophysics Unit (MBU), IISc, och huvudförfattaren till studien. Teamet bestämde sig för att testa sin hypotes genom att använda ett av miniproteinerna som kallas SIH-5 för att inrikta sig på interaktionen mellan Spike (S)-proteinet av SARS-CoV-2- och ACE2-proteinet i mänskliga celler.
S-proteinet är en trimer - ett komplex av tre identiska polypeptider. Varje polypeptid innehåller en Receptor Binding Domain (RBD) som binder till ACE2-receptorn på värdcellytan. Denna interaktion underlättar viralt inträde i cellen.
SIH-5-miniproteinet designades för att blockera bindningen av RBD till humant ACE2. När en SIH-5-dimer påträffade ett S-protein, band en av dess ytor tätt till en av de tre RBD:erna på S-proteintrimeren, och den andra ytan band till en RBD från ett annat S-protein. Denna "tvärbindning" gjorde det möjligt för miniproteinet att blockera båda S-proteinerna samtidigt. "Flera monomerer kan blockera sina mål", säger Chatterjee. "[Men] tvärbindning av S-proteiner blockerar deras verkan många gånger mer effektivt. Detta kallas aviditetseffekten."
Under cryo-EM verkade S-proteinerna som SIH-5 riktade sig till vara fästa head-to-head. "Vi förväntade oss att se ett komplex av en spiktrimer med SIH-5-peptider. Men jag såg en struktur som var mycket mer långsträckt", säger Somnath Dutta, biträdande professor vid MBU och en av motsvarande författare. Dutta och de andra insåg att spikproteinerna tvingades bilda dimerer och klumpade ihop sig till komplex med miniproteinet. Denna typ av klumpar kan samtidigt inaktivera flera spikproteiner av samma virus och till och med flera viruspartiklar. "Jag har arbetat med antikroppar mot spikproteinet tidigare och observerat dem under en cryo-EM. Men de skapade aldrig dimerer av spikarna", säger Dutta.
Miniproteinet visade sig också vara termostabilt - det kan förvaras i månader i rumstemperatur utan att försämras.
Nästa steg var att fråga om SIH-5 skulle vara användbart för att förhindra COVID-19-infektion.
För att svara på detta testade teamet först miniproteinet för toxicitet i däggdjursceller i labbet och fann att det var säkert. Därefter, i experiment utförda i labbet av Raghavan Varadarajan, professor vid MBU, doserades hamstrar med miniproteinet, följt av exponering för SARS-CoV-2. Dessa djur visade ingen viktminskning och hade kraftigt minskad virusmängd samt mycket mindre cellskador i lungorna, jämfört med hamstrar som bara exponerades för viruset.
Forskarna tror att med mindre modifieringar och peptidteknik kan detta labbtillverkade miniprotein också hämma andra protein-proteininteraktioner. + Utforska vidare