Kredit:Angewandte Chemie (2022). DOI:10.1002/ange.202117849
O-kopplad β-N-acetylglukosamin (O-GlcNAcylering), en viktig posttranslationell modifiering (PTM) av proteiner, är involverad i olika biologiska funktioner.
Den reversibla modifieringen av O-GlcNAc ger on-off proteinfunktioner under biologiska processer. Avvikelser av O-GlcNAcylering är nära förknippade med många metabola sjukdomar tillsammans med invasionen och metastaseringen av flera tumörer.
Nyligen har ett forskarlag lett av prof. Ye Mingliang och prof. Qin Hongqiang från Dalian Institute of Chemical Physics (DICP) vid den kinesiska vetenskapsakademin (CAS), i samarbete med prof. Huang Wei från Shanghai Institute of Materia Medica av CAS, utvecklade en ny strategi för reversibel kemoenzymatisk märkning av O-GlcNAc-glykopeptider, vilket möjliggjorde en djupgående analys av protein O-GlcNAcylering.
Deras resultat publicerades i Angewandte Chemie den 14 mars.
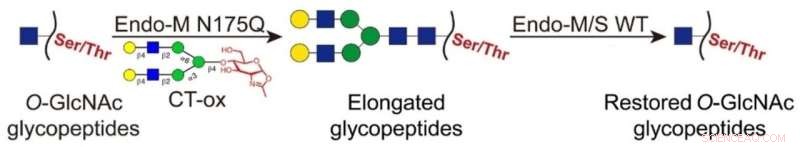
För att möjliggöra proteomomfattande analys av O-GlcNAcylering är det viktigt att selektivt berika glykopeptider från smältningen av komplexa prover.
Många forskare har sökt anrikningen av O-GlcNAcylerade peptider före analys med vätskekromatografi med tandemmasspektrometri (LC-MS/MS). Men de flesta tillvägagångssätten lider av svag bindningsaffinitet eller skrymmande taggar, som stör anrikningen och identifieringen av O-GlcNAcylerade peptider.
I denna nyutvecklade strategi ligerades O-GlcNAc-delarna med långa N-glykaner med användning av en Endo-M-mutant, vilket möjliggjorde anrikningen av de märkta glykopeptiderna genom hydrofil interaktionsvätskekromatografi (HILIC). Sedan avlägsnades de fästa glykanerna på de anrikade glykopeptiderna med vildtyp Endo-M/S för att återställa O-GlcNAc-delen.
Jämfört med den klassiska kemoenzymatiska märkningen, möjliggjorde detta tillvägagångssätt tag-fri identifiering och eliminerade störningen av skrymmande taggar i glykopeptiddetektering.
Dessutom, genom att använda denna metod, identifierade forskarna 657 potentiella O-GlcNAc-glykosider från endast 0,4 mg HeLa-cellkärnproteiner, vilket behövdes endast 1/10 av proteinproverna för en jämförbar O-GlcNAcyleringsanalys, vilket indikerar den höga känsligheten hos detta metod.
Totalt identifierade de 1 414 glykositer från bara 1,1 mg proteinprover, och 45 % av dem ingick inte i O-GlcNAcAltas av alla mänskliga prover under de senaste 35 åren, vilket förbättrade analystäckningen av protein O-GlcNAcylering.
"Denna tag-fria anrikningsstrategi representerar en unik väg för proteomomfattande analys av O-GlcNAcylering och främjar mekanismstudier", säger Prof. Ye. + Utforska vidare