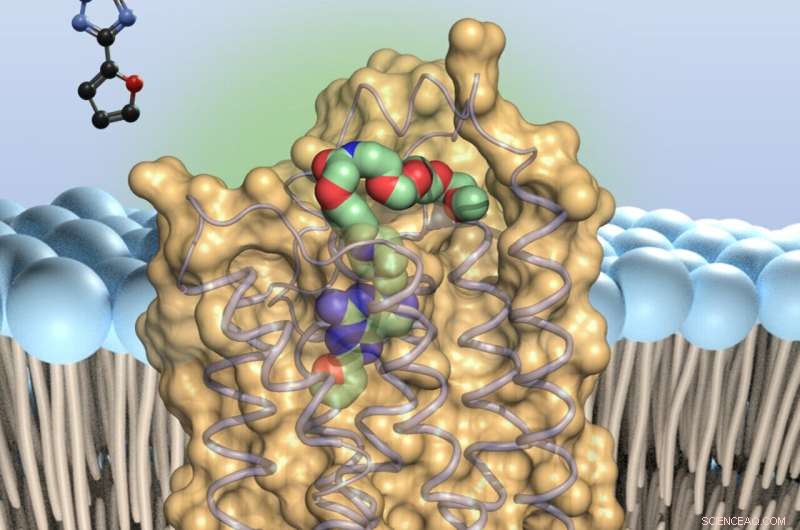
Adenosinantagonisten (färgad) - binder till små antenner på ytan av immuncellerna, adenosinreceptorerna av typ 2A. Detta saktar ner immunstyrkorna. Kredit:University of Bonn
A2A-receptorn reglerar hur kraftigt det medfödda immunförsvaret angriper sjuka celler. Forskare vid universitetet i Bonn har nu för första gången kunnat visa hur en viktig hämmare binder till receptorn. I framtiden kommer resultaten att underlätta det riktade sökandet efter molekyler som ger det medfödda immunförsvaret mer kraft. Dessa kan till exempel användas i kampen mot cancer, men också mot hjärnsjukdomar som Alzheimers eller Parkinsons sjukdom. Den slutliga versionen av studien har publicerats i tidskriften Angewandte Chemie International Edition .
Alla som tycker om att läsa thrillers vet:Innan tjuvar tar sig in i en herrgård, kastar de gärna en saftig kotlett över staketet, där de har gömt några sömntabletter. När vakthundarna kommer ner till sin andra middag dukar de för djup sömn kort därefter. Juvelerna hos damen i huset byter ägare mycket mer ostört efter det.
Tumörceller går ofta tillväga på ett mycket liknande sätt:De kastar ut sömntabletter som förlamar immunförsvaret. Mer specifikt omger de sig med ett moln av adenosin, en viktig endogen budbärare. På så sätt inaktiverar de kroppens egna "mördarceller", som annars skulle få cancercellerna att dö.
Detta beror på att adenosinmolekylerna binder till små antenner på ytan av immuncellerna, A2A-receptorerna (förkortningen står för "typ 2A adenosinreceptorer"). Detta slår ut defensiva trupperna, så att säga. Forskare runt om i världen letar därför efter molekyler som kan blockera A2A-receptorn och förhindra den förlamande effekten av adenosin.
Bombardering med röntgenstrålar
"Vår studie borde göra den här sökningen mycket enklare", förklarar Prof. Dr. Christa Müller från Pharmaceutical Institute vid universitetet i Bonn. "Vi har lagt till nya varianter av en känd hämmare, en substans som kallas preladenant, till A2A-receptorn. Sedan skapade vi kristaller från receptor-inhibitor-komplexen - det är första gången i världen som detta har uppnåtts med preladenant-liknande ämnen. "
Kristallisering gjorde det möjligt att belysa komplexets struktur. "För att göra detta bombarderar vi föreningen med röntgenstrålar", förklarar Tobias Claff, som utförde huvuddelen av experimenten. "Kristallen diffrakterar strålarna. Sättet den gör detta gör det möjligt för oss att härleda komplexets rumsliga struktur – ända ner till arrangemanget av individuella atomer och deras interaktioner."
På så sätt kunde forskarna visa till vilka punkter av A2A-receptorpreladenant binder. Med denna kunskap är det nu möjligt att specifikt modifiera inhibitorn för att ge den bättre egenskaper. Förutom att ha starkast möjliga effekt ska läkemedel till exempel inte brytas ner för snabbt. De måste också kunna nå platsen där de ska utföra sitt arbete – i det här fallet hjärnan. "Vår studie kommer att göra det mycket lättare att optimera ämnet," säger Claff med optimism.
A2A tillhör en grupp receptorer som reglerar viktiga funktioner i kroppen. De spänner över cellmembranet. Den del av dem som sitter på utsidan av membranet fungerar som en sensor, som tar emot molekylära signaler som en antenn. När den gör det utlöser den specifika reaktioner med sin del som sticker ut i cellen. Detta aktiverar sedan vissa gener, till exempel.
Färgämne bundet till den hämmande molekylen
"Dessa receptorer är oerhört viktiga på grund av deras centrala position", säger Christa Müller, som också är medlem i de transdisciplinära forskningsområdena (TRA) "Building Blocks of Matter" och "Life and Health." "Många av dem är dock tyvärr relativt instabila. Detta är ogynnsamt för röntgenstrukturanalyser - kristallisering tar dagar, ibland till och med veckor." Forskarna modifierade därför specifikt A2A-receptorn vid en enda punkt, vilket gjorde den betydligt mer stabil.
Dessutom lyckades de fästa ett färgämne på preladenant med en sorts molekylär sträng. "Detta tillåter oss att kontrollera var i vävnaden preladenant fäster till A2A-receptorn," säger Müller. Samtidigt säkerställer längden och flexibiliteten hos nanosträngen att inhibitorn inte hindras från att binda till receptorn.
Båda framstegen skulle också kunna fungera som modeller för arbete med andra receptorer som tillhör samma grupp. "De metoder som vi har utvecklat i Bonn de senaste åren kommer att göra det möjligt för oss att belysa strukturen hos sådana och andra cellmembranproteiner i framtiden", är farmaceuten övertygad. "Det finns inte många forskningsanläggningar som kan göra den här typen av strukturanalys av extremt komplexa molekyler." + Utforska vidare