Även om du kanske aldrig har hört talas om cytokrom P450-superfamiljen av enzymer, spelar dessa proteiner olika och kritiska roller hos människor genom metabolisk bearbetning av läkemedel, bekämpningsmedel, fettsyror, fettlösliga vitaminer och kemiska cancerframkallande ämnen och biosyntesen av essentiella steroider, inklusive steroler.
Steroler är en familj av kemiska föreningar som delar en central, ringad struktur och som är avgörande för livet för en mängd organismer. Den mest kända sterolen hos människor är kolesterol, en nyckelkomponent i vårt cellmembran och en ständigt närvarande punkt i läkarnas sinnen med tanke på att förhöjda kolesterolnivåer i blodet kan öka vår risk för hjärt-kärlsjukdom.
Laboratoriet av Fred Guengerich, Tadashi Inagami, Ph.D. Professor i biokemi vid Vanderbilt University, har studerat cytokrom P450 i 50 år. I en ny artikel publicerad i Angewandte Chemie , undersökte Guengerich-labbet mekanismen som används av cytokrom P450 51 – ett P450-enzym som finns i alla livsfamiljer – för att katalysera en kritisk trestegsreaktion i sterolbiosyntesen:metabolismen av lanosterol.
"Detta har varit ett utmanande men givande projekt som ger det första otvetydiga svaret på en långvarig och kontroversiell mekanistisk fråga i biosyntesen av eukaryota steroler", säger huvudförfattaren och biokemistudenten Kevin McCarty.
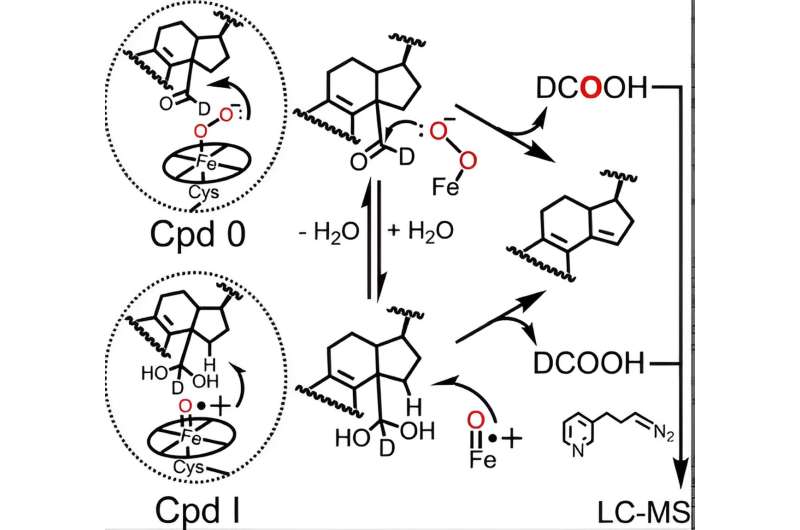
Den katalytiska cykeln för alla P450-enzymer involverar bildningen av två aktiva hemjärnsorter - Förening 0 och Förening I, varav den senare är naturligt bildad från Förening 0 - som är nödvändiga för P450-katalyserade reaktioner, inklusive lanosterolmetabolism. Även om rollen av förening I i de första två stegen av lanosterolmetabolism har varit väl etablerad, har motstridiga data från olika laboratorier gjort forskarna oklart om P450 51 använder förening 0 eller förening I för att utföra det avgörande sista steget.
Genom att använda en avancerad analytisk teknik som ursprungligen förfinats av tidigare Guengerich postdoc Francis Yoshimoto som spårar inkorporeringen av en syreisotop som kallas 18 O i produkterna från P450-reaktionen har McCarty och kollegor blivit de första att föreslå att både förening 0 och förening I kan spela aktiva kemiska roller i det sista steget av lanosterolmetabolism.
Faktum är att resultaten presenteras i Angewandte Chemie papper indikerar att även om förening 0 är den huvudsakliga hemarten som är ansvarig för det sista steget av mänsklig P450 51:s katalytiska verkan (~85% av reaktionen), spelar förening I fortfarande en mindre, kvantifierbar roll (~14% av reaktionen).
I samarbete med Galina Lepesheva, forskningsprofessor i biokemi, jämförde forskarna de relativa bidragen från varje hemart i fyra P450 51-enzymer från patogen jäst, amöba och trypanosomer, en typ av parasit, till den mänskliga ortologen. Medan enzymerna från jäst och amöba visade liknande resultat som det mänskliga proteinet, visade resultaten från de trypanosomala enzymerna en intressant mekanistisk skillnad:Förening 0 och Förening I delade ungefär lika stora bidrag till reaktionen.
Dessa resultat ger djup till vår samlade och mekanistiska förståelse av P450-enzymer, särskilt de som är involverade i sterolbiosyntes.
"Detta var ett långt projekt som krävde en 17-stegs kemisk syntes, fem olika renade P450 51-enzymer från vår samarbetspartner Prof. Galina Lepesheva, mycket noggrann uppmärksamhet på att använda en 18-syreatmosfär i reaktionerna, sofistikerad högupplöst masspektrometri, och noggrant arbete av alla författarna i vårt labb," sa Guengerich. Enligt honom tillät hans teams uppmärksamhet på detaljer det att "knäcka det här systemet" och ge en tydlig analys av en förgrenad enzymmekanism.
"Våra fynd ger ett viktigt framsteg i förståelsen av P450 51-funktionen i mänskliga och olika patogener, vilket vi hoppas kommer att vara användbart i det fortsatta sökandet efter P450 51-riktade läkemedel," sa McCarty.
För närvarande hämmar ett antal befintliga svampdödande läkemedel svampens P450 51-enzymer för att störa organismens förmåga att tillverka essentiella steroler och föröka sig. Ändå understryker resistens mot svampdödande medel, tillsammans med förekomsten av livshotande svampinfektioner för vilka det inte finns någon behandling, det fortsatta behovet av nya P450 51-inriktade läkemedel.
Ser fram emot kommer laboratorierna i Guengerich och Lepesheva att analysera ytterligare ett P450 51-enzym från amöban i jakt på mekanistiska egenheter som kan användas som potentiella läkemedelsmål.
Mer information: Kevin D. McCarty et al, Oxygen‐18 Labeling Reveals a Mixed Fe−O Mechanism in the Last Step of Cytochrome P450 51 Sterol 14α‐Demethylation, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317711
Tillhandahålls av Vanderbilt University