Antikroppar (immunoglobuliner) är Y-formade proteiner som känner igen och neutraliserar specifika patogener. Deras förmåga att rikta in sig på specifika molekyler eller celler har gjort dem till lovande kandidater för framtida läkemedelsutveckling. Men deras lätta kedjor – delar av antikroppen som bidrar till att känna igen och binda till specifika antigener – felveckas och aggregeras, vilket leder till amyloidos, ett tillstånd som orsakar komplikationer och vävnadsdysfunktion i kroppen.
I samband med läkemedelsutveckling kan antikroppsaggregation äventyra deras förmåga att binda till antigener och minska deras terapeutiska potential. Men bristen på detaljerad strukturell information om dess aggregering är en av faktorerna som hindrar framsteg på området.
Som ett resultat av detta syftar pågående ansträngningar till att tillhandahålla detaljerade rapporter om aggregerade strukturer och deras bildningsmekanismer för att främja utvecklingen av antikroppsläkemedel.
I en studie publicerad i Nature Communications , ett team av forskare från Japan, ledd av Shun Hirota från Nara Institute of Science and Technology (NAIST), har nyligen gett nya insikter i de strukturer som bildas under antikroppsaggregation genom 3D-domänbyte (3D-DS), en process där en specifik region av ett protein utbyts mellan två eller flera molekyler av samma protein.
3D-DS-processen har observerats i olika proteiner men inte i lätta antikroppskedjor förrän i denna studie.
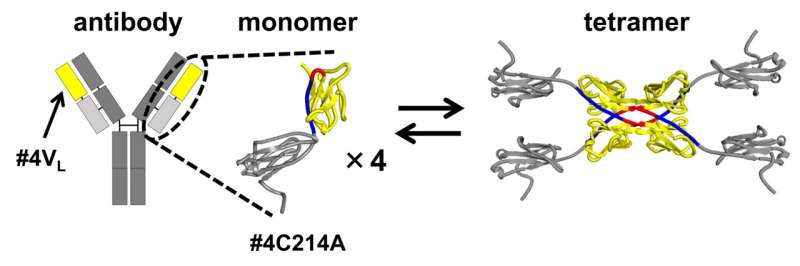
I sin undersökning använde forskarna en modifierad version av antikroppens lätta kedja. I denna modifierade form ersattes en cysteinrest (Cys), som typiskt bildar en disulfidbindning med en tung kedja av cystein, med alanin (Ala). Denna förändring gjorde det möjligt för teamet att isolera och studera strukturerna som härrör från 3D-DS i det segment av antikroppen som bidrar till antigenbindning.
3D-DS i antikroppens lätta kedja involverar bildandet av dimerer (strukturer som består av två identiska subenheter) och tetramerer (strukturer som består av två dimerer med fyra identiska subenheter).
"Vår studie ger den första rapporten om strukturen på atomnivå av 3D-DS-fenomenet i en antikropps lätta kedjas variabla region", påpekar Hirota.
Storleksuteslutningskromatografin av antikroppens lätta kedja #4C214A avslöjade att antikroppen existerar som individuella monomerer och fyra-subenhetstetramerer. För att bestämma regionen där tetramerer bildas delade forskarna antikroppens lätta kedja i den variabla regionen (spetsen på den Y-formade antikroppen) och den konstanta regionen (den mellersta delen av den Y-formade antikroppen).
De fann att den variabla regionen #4VL kan växla mellan monomera och tetramera tillstånd.
Ytterligare analys med röntgenkristallografi och termodynamiska simuleringar visade att tetramerbildningen drivs av hydrofoba interaktioner mellan två 3D-DS-dimerer.
Jämfört med monomerer visade sig tetramererna ha styvare β-arkstrukturer, vilket gör dem mindre flexibla. Bildandet av 3D-DS-tetrameren kan hjälpa till att förhindra proteinaggregation genom att minska flexibiliteten, vilket potentiellt undviker bildandet av olösliga aggregat. Å andra sidan kan 3D-DS främja aggregering av antikroppar.
Hirota avslutar:"Dessa fynd klargör inte bara den domänbytta strukturen hos antikroppens lätta kedja utan bidrar också till att kontrollera antikroppskvaliteten och främja utvecklingen av framtida molekylära igenkänningsämnen och läkemedel."
Mer information: Strukturella och termodynamiska insikter i antikropps lättkedje-tetramerbildning genom 3D-domänbyte, naturkommunikation (2023). DOI:10.1038/s41467-023-43443-4
Tillhandahålls av Nara Institute of Science and Technology