
Den självresonanta mikrohelixen. (A) En tillverkad fem-varv microhelix lindad runt en 0,4 mm-ytterdiameter kapillär. Under tillverkningen, mikrohelixen lindas tätt runt en 0,4 mm borr och limmas inuti en Rexolite-cylinder. Borrkronan tas bort, och limmet får torka i flera dagar. Microhelix -enheten placeras i (B) en kopplings- och stödmontering, som inkluderar en plan mikrokopplare. (C) Den plana mikrokopplaren består av en stripline -impedansmatchning till en induktiv kopplingsslinga. SMA, Sub-miniatyrversion A. (D) Modelleringsimuleringar av ändliga element av mikrovågsmagnetfältet, normaliserad till ineffekt, vid 9,5 GHz visar ett aktivt område med god magnetfältshomogenitet över en 0,8 mm höjd. Det uppmätta mikrovågsmagnetfältet på 3,2 G/W1/2 motsvarar en 20-ns π/2-puls vid cirka 20 mW. Mått på mikrohelixen, där självresonansen bestäms av kapacitansen som bildas mellan varje varv och lindarnas induktans, visas. Frekvensen kan ställas in under tillverkningen med antalet varv, stigningen i svängarna, eller innerdiametern. Upphovsman:Science Advances, doi:10.1126/sciadv.aay1394
Biokemister kan använda elektronparamagnetisk resonans (EPR) på proteinenkristaller för att bestämma den ultimata elektroniska strukturen hos paramagnetiska proteinmellanprodukter och undersöka den relativa magnetiska tensorn till en molekylstruktur. Metoden är, dock, bibehålls av typiska proteinkristalldimensioner (0,05 till 0,3 mm) som inte ger tillräcklig signalintensitet under proteinkristallografi. I en ny studie om Vetenskapliga framsteg , Jason W. Sidabras och ett tvärvetenskapligt forskargrupp vid avdelningarna för kemisk energiomvandling, Fotobioteknik, Institutet för biologi och experimentell fysik i Tyskland presenterade en mikrovågssjälvresonant mikrohelix för att kvantifiera nanoliterprover. Forskarna implementerade tekniken i ett kommersiellt X-band (mellanfrekvens; 9,5 GHz) EPR-spektrometer. Den självresonanta mikrohelixen gav en uppmätt signal-till-brusförbättring jämfört med andra kommersiella EPR-resonatorer. Arbetet möjliggör avancerade EPR-tekniker för att studera proteinkristaller för röntgenkristallografi, utan storleksrelaterade undantag eller utmaningar. För att demonstrera metoden, Sidabras et al. använde enkristallprotein [FeFe] -hydrogenas (från Clostridium pasteurianum ) med 0,3 mm x 0,1 mm x 0,1 mm dimensioner.
Primärförfattare Jason W. Sidabras, för närvarande Marie Sklowdowska-Curie Actions Fellow vid Max Planck Institute for Chemical Energy Conversion i Tyskland, kommenterade vidare arbetet med andra forskare professor Wolfgang Lubitz och dr Edward J. Reijerse. "Även om vi började med [FeFe] -hydrogenas här, Vi har försökt undersöka enkristall EPR-dynamik i åratal och den nuvarande tekniken är inte begränsad till övergångsmetaller ensamma. Metoden som definieras i studien är tillämpbar för att övervaka all enzymaktivitet inom en stabil proteinmellanprodukt." Han noterade vidare deras syfte att använda tekniken för att minska befintliga kostnader för puls EPR-teknik och ersätta dyra högeffektsförstärkare för sparsam vetenskap (ekonomiskt sett). kostnadseffektiva strategier inom vetenskap).
Forskare använder vanligtvis EPR -spektroskopi för att undersöka den katalytiska cykeln för redoxenzymer som innehåller paramagnetiska mellanprodukter och få information om den elektroniska och geometriska strukturen för en aktiv enzymatisk plats. Rent generellt, för att utföra EPR-experiment på proteiner, forskare förbereder en frusen lösning (koncentration mellan 0,1 till 1 mM) och placerar en volym (200 µl) i en mikrovågshålighet för att få magnetiska interaktioner på en aktiv plats, med begränsad syn på den elektroniska strukturen. För att helt lösa tensormagnetiska interaktionsparametrar, de måste utföra enkristall EPR-experiment där magnetiska interaktionstensorer kan kombineras med röntgenkristallografi för att demonstrera proteingometri och förstå katalytiska mekanismer hos enzymer. Dock, enkristall EPR appliceras sällan på proteinsystem på grund av utmaningar att få kristaller med lämpliga volymer och storlekar. Många proteiner i området 0,05 till 0,3 mm är för små för analys med kommersiell EPR -instrumentering.
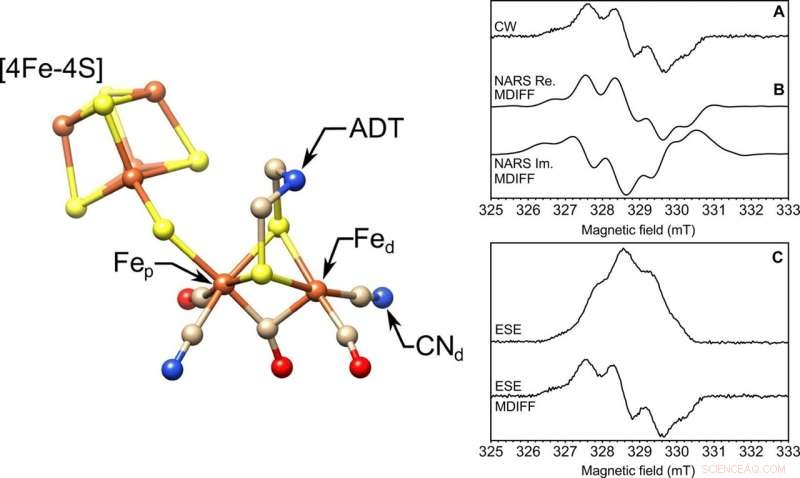
VÄNSTER:Molekylstrukturen för det [FeFe] -hydrogenas aktiva stället, H-klustret. Markerade är de proximala och distala järnen, Fep och Fed, respektive, cyanidliganden (CN−d), och ADT -liganden. S, gul; Fe, orange; N, blå; C, solbränna; O, röd. Strukturen är från Protein Data Bank (PDB) ID 4XDC. HÖGER:Fryst lösning EPR på ett 85-nl-volymprov vid X-band. Tre EPR-experiment utförda med en 0,4 mm innerdiameter självresonant mikrohelix. Visas (A) kontinuerlig våg (CW), (B) verklig (Re.) Och imaginär (Im.) Nonadiabatisk snabbskanning (NARS), och (C) tvåpuls ESE EPR-experiment med tyrosin D-radikalen (Y ∙ D) i fotosystem II med 85 nl fryst lösningsprov vid en temperatur av 80 K. Beräknad MDIFF (rörlig skillnad) pseudomodulering av 0,5 mT visas för NARS och fält-svepte ESE-experiment för att direkt jämföra med EPR-experimentet med kontinuerlig våg. Den totala tiden för experimenten var 49, 55, och 45 min, respektive. Signal-brusförhållandet beräknas och tabelleras. Upphovsman:Science Advances, doi:10.1126/sciadv.aay1394.
För att förbättra EPR -känsligheten för att studera enstaka kristaller, vanligtvis på X-bandet, forskare måste överge designen av mikrovågsutrymmet och gå mot resonatorer med liten volym i mikrovågsutbudet. Strategin kan underlätta minskade provvolymer från 200 till 20 µl med hjälp av en loop-gap-resonator (LGR) och ytterligare minskningar med hög dielektriska konstanta material för att minska den aktiva volymen till en mikroliter. Proteinkristallundersökningar kräver ytterligare volymminskningar (mindre än 0,03 µl) och det kräver ett radikalt tillvägagångssätt. För att åstadkomma detta, Sidabras et al. kombinerade en självresonant mikrohelix och en plan mikrokopplare på ett kretskort, som drev den självresonanta mikrohelixen placerad i mitten av kopplingsslingan. Mikrohelix -geometrin erbjöd fördelar med en starkt förbättrad mikrovågsfälthomogenitet och högre volymkänslighet för små prover jämfört med andra mikroresonatorer. Teamet optimerade den självresonanta mikrohelixen för puls- och kontinuerliga vågsexperiment som kräver mycket lite mikrovågseffekt. De matchade och justerade enkelt mikrohelixen över en mängd olika prover och temperaturer.
I det nuvarande arbetet, laget använde den självresonanta mikrohelixen för att undersöka EPR-kristallrotation av [FeFe] -hydrogenas i det aktiva oxiderade tillståndet (H OXE ; kristallmått 3 mm med 0,1 mm med 0,1 mm), från Clostridium pasteurianum (anaerob bakterie). De utförde avancerade puls-EPR-experiment på strukturen för att observera utmärkt signal-brus-förhållande. Data visade användningen av mikrohelixen för att studera enkristallproteiner vid volymer som är lämpliga för röntgenkristallografi. Under experiment, forskargruppen lindade den självresonanta mikrohelix-geometrin runt en 0,4 mm kapillär och fäst enheten till en anpassad insats kompatibel med kommersiella EPR-system. De genomförde ett EPR-experiment med kontinuerlig våg med hjälp av en frusen lösning och förbättrade signal-till-brusförhållandet (SNR) för arbetet med hjälp av ett fältsvept nonadiabatic rapid scan (NARS) experiment.
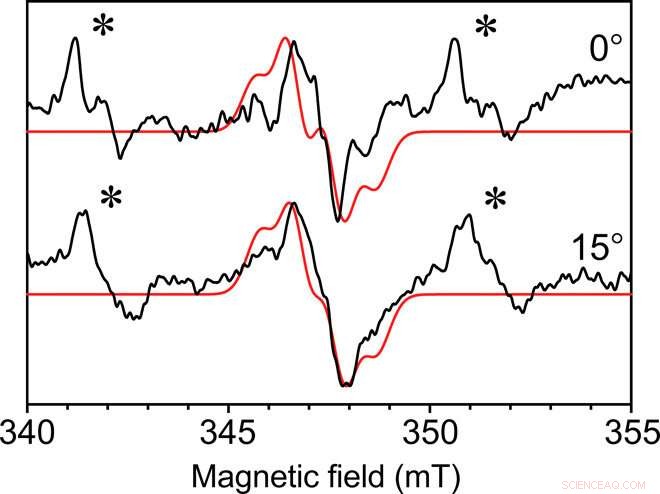
Enkristallisk kontinuerlig våg EPR av Y ∙ D i fotosystem II-kärnskomplexet. Kontinuerlig våg-EPR uppsamlad med 0,4 mm inre diameter självresonant mikrohelix vid två vinklar av fotosystem II Y∙D radikal från en enkristall vid en temperatur av 80 K. Kristalldimensionerna var 0,3 mm gånger 0,18 mm gånger 0,18 mm. Visas i rött är en monterad simulering med liknande funktioner. En ospecifikt bunden Mn2+ -signal finns också i kristallens moderlut, indikeras med en asterisk (∗). Varje spektrum samlades in på 49 minuter med ett signal-brus-förhållande på cirka 35. Kredit:Science Advances, doi:10.1126/sciadv.aay1394.
De använde en långlivad tyrosin D-radikal (Y ∙ D) som en standardprob under experiment med tidigare välkarakteriserade egenskaper. För att generera tyrosinradikal (Y ∙ D) EPR -signal, teamet belyste prover av fotosystem II -kärnkomplexet (membranproteinkomplex) i omgivande ljus och frös dem snabbt. De genomförde flera experiment för att demonstrera mångsidigheten hos mikrohelixen under EPR-mätningar över en mängd olika prover (mindre än 85 nanoliter i volym) vid X-band. Sidabras et al. använde fotosystem II -kristallerna som riktmärke trots dess utmanande konstitution. Strukturellt sett fotosystem II -komplexet innehöll en molekylmassa ungefär 350 kDa med varje komponent innehållande endast en Y ∙ D -radikal. Totalt, med åtta fotosystem II -komplex per cell enhet beräknade forskarna 8,9 x 10 12 Y∙D radikaler, för att demonstrera EPR -metodens mångsidighet för att studera stora komplex i små kristalldimensioner.
Efter att ha fastställt lämpligheten hos den självresonanta mikrohelixen för att studera enkristallproteinprover, teamet utökade arbetet för att demonstrera fullständig vinkelbestämning av g-tensor (energiförskjutning associerad med molekylär övergång) och för att undersöka avancerade puls-EPR-experiment såsom elektronspin-eko-envelopemodulation (ESEEM) eller hyperfin sublevel-korrelation (HYSCORE). De optimerade den självresonanta mikrohelixen för dessa experiment. Teamfält svepte tvåpuls ESE (elektronspinneko) EPR-experiment på en proteinkristall av [FeFe] -hydrogenas av C. pasteurianum (Cpl) i det oxiderade H OXE tillstånd i en anerob kammare under ett mikroskop för att ta upp proteinkristaller via kapillärverkan till ett kapillarrör.

Puls EPR på en enda kristall av H-klustret i [FeFe] -hydrogenas. (A) molekylstrukturen för det [FeFe] -hydrogenas aktiva stället, H-klustret, från PDB ID 4XDC visas med den molekylära ramen placerad med distalt järn (Fed) som ursprung. S, gul; Fe, orange; N, blå; C, solbränna; O, röd. (B) P1211 -symmetrischematiken som hänför sig till den molekylära ramen (x, y, z) till kristallramen (a, b, c) och, sista, till laboratoriesystemets ram (L1, L2, L3) visas. De två molekylära ramarna från den asymmetriska enheten finns på plats I och kan översättas till plats II med kristallsymmetrioperationer. (C) Det statiska magnetfältet (B0) är placerat längs L1 -axeln, medan mikrovågsmagnetfältet (B1) kan vara antingen längs L2 -axeln eller längs L3 -axeln. En rotation på 180° är möjlig runt L3-axeln, men endast en partiell rotation runt L2 -axeln är möjlig på grund av att B1 roterar med kristallen vilket resulterar i att B1 blir parallell med B0. En tredje delrotation är möjlig om provet roteras 90 ° runt L2 -axeln. (D) Puls EPR-experiment insamlade med den självresonerande mikrohelixen med en inre diameter på 0,4 mm med en [FeFe]-hydrogenas-enkristall av C. pasteurianum (CpI) i Hox-tillståndet som visar insamlade data i ett plan för en full rotation av 180° i steg om 5 ° vid en temperatur av 15 K. Kristallmåtten var ungefär 0,3 mm med 0,1 mm med 0,1 mm, och varje spektrum samlades in på 8 minuter med ett signal-brusförhållande på cirka 290. (E) En stereovy av den analyserade g-tensorn (gx, röd; gy, grön; och gz, blå) mappas på kristallstrukturen (PDB ID:4XDC). För en tredimensionell (3D) vy av den föreslagna g-tensorn, se https://act-epr.org/FeFeHydrogenase.html. Upphovsman:Science Advances, doi:10.1126/sciadv.aay1394.
De inkluderade sedan kryoskyddsmedel och media i mikrohelixen följt av flash-frysning för att producera en EPR-signal med fyra distinkta signaler i spektrumet i förhållande till proteinstrukturen. Forskarna anpassade data i simuleringar som hänför sig till olika referensramar definierade via EasySpin -simuleringspaketet för EPR -spektrumsimulering. Teamet skapade en schematisk koppling av [FeFe] -hydrogenas H-klustermolekylram till laboratoriesystemramen. För alla arter som undersöktes i experimenten, laget bestämde g-tensors storlek och orientering med hjälp av ligandfältsteori och verifierade resultaten med kvantkemiska beräkningar. Teamet underlättade grundläggande insikter i den elektroniska strukturen och noterade deras beroende av ligandsfären och observerade behovet av optimerade strategier.
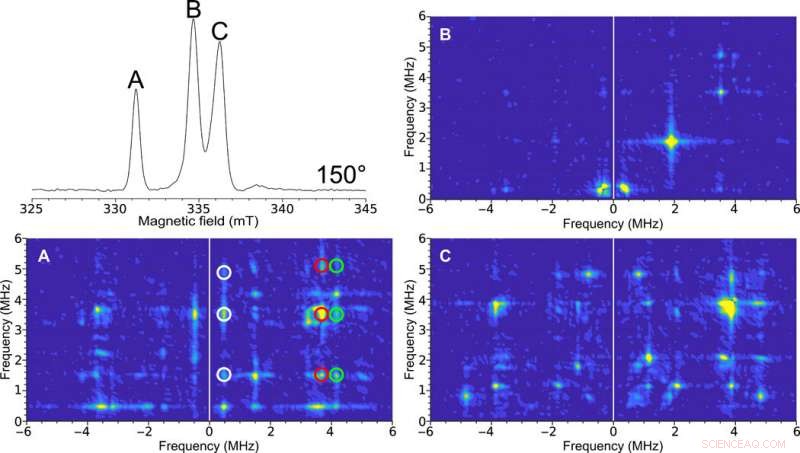
Enkristall HYSCORE EPR av H-klustret i [FeFe] -hydrogenas. Överst till vänster:Fält svept tvåpuls ESE EPR-spektrum vid 150 °. Figuretiketterna (A, B, och C) är representativa för spektraltopparna. HYSCORE-spektra uppsamlade med 0,4 mm självresonant mikrohelix med inre diameter av en [FeFe]-hydrogenas-enkristall av C. pasteurianum (Cpl) i Hox-tillståndet vid en orientering av 150° uppsamlad vid en temperatur av 15 K. 2D densitetsrepresentation visar korrelationer mellan nukleära spinnövergångarna i båda projektionerna av den elektroniska snurran. (A) Ren HYSCORE -spektrum på grund av toppen motsvarar endast en av EPR -signalerna i enhetens cell i kristallen. De korrelerade egenskaperna mellan dessa övergångar indikeras av det vita, röd, och gröna cirklar. (B) Relativt prestationslöst HYSCORE -spektrum antyder lite hyperfin interaktion vid denna orientering. (C) HYSCORE på två överlappande EPR-signaler som representerar olika orienteringar av enzymmolekylen med avseende på magnetfältet. The HYSCORE was set up using the Bruker HYSCORE wizard with the following settings:π/2, 40 ns; τ, 280 ns; and Δτ, 48 ns with 256 points each and 20 shots per point. Each HYSCORE spectrum was collected in approximately 1 hour. Upphovsman:Science Advances, doi:10.1126/sciadv.aay1394.
The researchers illustrated more advanced experiments for single-crystal studies using HYSCORE (hyperfine sublevel correlation) experiments for the ESE (electron spin echo) EPR dataset. För detta, they obtained a single-crystal 2-D spectrum for the H-cluster in [FeFe]-hydrogenase crystals and identified six main transitions. Sidabras et al. highlighted the feasibility of these advanced EPR techniques in the present work and related them to the electronic structure predicted using quantum chemical calculations. The team aim to address additional molecular couplings of ligands in depth using ESEEM/HYSCORE techniques in the future.
På det här sättet, Jason W. Sidabras and colleagues presented an advanced resonator to design and collect EPR data from a 3 mm by 0.1 mm by 0.1 mm single crystal of [FeFe]-hydrogenase in the H OX state from C. pasteurianum (Cpl). The HYSCORE spectra obtained from a protein single crystal in the present work were a first in study. Additional work proposed by the team will facilitate further insight for protein engineering and artificial enzyme research to create bioinspired and biomimetic enzymatic systems. I synnerhet, the self-resonant microhelix engineered in the work can allow biochemists to study diverse catalytically active proteins at crystal dimensions relative to X-ray crystallography, which will pave the way for significant advancements in the field of enzyme research.
© 2019 Science X Network