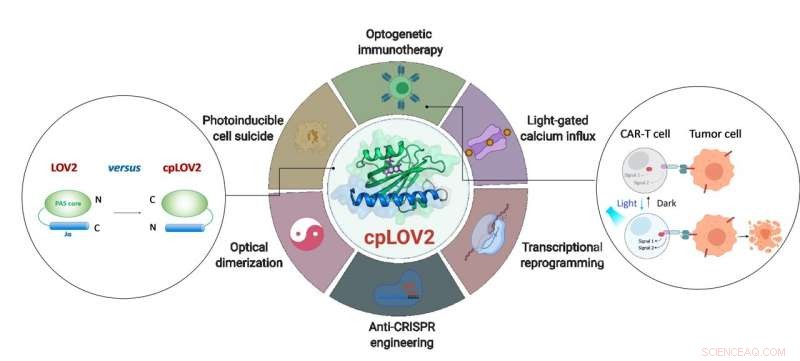
Utformningen av cpLOV2 och dess utökade tillämpning inom optogenetisk teknik. Upphovsman:ZHU Lei
Nyligen, Prof. WANG Junfeng från High Magnetic Field Laboratory vid Hefei Institutes of Physical Science (HFIPS), tillsammans med internationella forskare, utvecklat en ny cirkulär permuterad ljus-syre-spänning 2 (LOV2) för att utöka repertoaren för genetiskt kodade fotoswitchar, vilket kommer att påskynda utformningen av nya optogenetiska enheter. Resultatet publicerades i Natur kemisk biologi .
LOV2-domänen är en blå ljuskänslig fotoswitch. I en typisk LOV2-baserad optogenetisk enhet, en effektordomän är smält efter den C-terminala Jα-helixen i LOV2, avsikt att buret av effektorn via steriskt hinder i mörkret. Vid fotostimulering, ljusutlöst utfällning av Jα-helixen exponerar effektordomänen för att återställa dess funktion. Att ta fram ett LOV2-baserat fotoswitchbart protein kräver ofta enorma tekniska ansträngningar för att optimera varje komponent och den anslutande länken däremellan. Därför, det är önskvärt att utöka den nuvarande optogenetiska verktygslådan genom att skapa nya moduler som förenklar dessa steg.
I den här studien, forskarna utformade cpLOV2 med hjälp av cirkulär permutation, en robust proteinteknisk metod som tidigare använts för att utveckla nya varianter av genetiskt kodade fluorescerande sonder och biokatalysatorer. Kväve (N) och kol (C) ändarna av cpLOV2 skapades vid N-änden av Jα-helix medan de gamla var anslutna med en glycin och serinrik länk. Därför, effektorn kunde smälta före den N-terminala Ja för cpLOV2 utöver C-terminalen i LOV2.
Med hjälp av högupplöst NMR -spektroskopi och andra tekniker, forskarna visade att den strukturella integriteten och funktionen av ljusinducerad Jα-dissociation av cpLOV2 bibehålls väl. cpLOV2 fungerade också väl i LOVTRAP och förbättrad ljusinducerad dimer (iLid), båda är LOV2 -baserade optiska heterodimeriseringssystem.
cpLOV2 gav fler valmöjligheter för optogenetiska applikationsutvecklingar. Forskarna genererade en serie hybrider genom att smälta LOV2 eller cpLOV2 med olika Ca 2+ kanalaktiverande och autoinhiberingsfragment härledda från stromal interaktionsmolekyl 1, och hittade flera nya cpLOV2 -baserade optiska ställdon till grinden ORAI1 Ca 2+ kanal, därför visade de att cpLOV2 hade råd med nya burytor för att övervinna begränsningar som är associerade med vildtyp LOV2.
För effektorer krävs en fri N -terminal för att utföra sin fulla funktion, cpLOV2 är ett bättre val. Ett viktigt protein involverat i nekroptos, blandat kinas-domänliknande (MLKL) protein, var den framgångsrika buret och den icke-burna i cpLOV2-MLKL men inte MLKL-LOV2 för optisk kontroll av cellmord.
Chimär antigenreceptor (CAR) T -cellterapi har framträtt som en lovande immunterapeutisk metod. Dock, den okontrollerbara CAR T-cellaktiviteten under behandlingen skulle orsaka allvarliga biverkningar t.ex. cytokinfrisättningssyndrom hos vissa patienter. Forskare utformade cpLOV2 -baserade optiska heterodimeriseringssystem (cpLID), och konstruerad fotostämbar delad CAR (optoCAR). De terapeutiska optoCAR T -cellerna kan specifikt aktiveras av CD19 -tumörantigen och blått ljus, och sedan föröka sig för att döda CD19 + Raji lymfomceller.
I musmodell implanterad med CD19 + Raji -celler, forskare använde upconversion nanopartiklar (UCNP) för att omvandla högvävnadspenetrativt nära-infrarött ljus till blått ljus och aktivera de injicerade optoCAR T-cellerna och uppnådde mycket effektiv behandling av lymfomtumör. OptoCAR T -celler som utvecklats i denna studie möjliggör spatiotemporal och reversibel kontroll av T -cellaktiviteter och cytokinproduktion.
Dessa uppmuntrande resultat tyder på att optoCAR T -celler kan mildra potentiella biverkningar utan att förlora terapeutisk effekt. I framtiden, de planerar att prova optogenetisk immunterapi för att behandla olika typer av cancer.