
Forskare har lyckats registrera den elektriska potentialen över membranet hos sammandragande hjärtceller (symbol). Kredit:Keystone / Science Photo Library / Beermedia / Fotolia / Montage
För första gången, forskare har lyckats registrera strömmen i membrankanalerna hos sammandragande hjärtceller. Att göra detta, forskarna kombinerade ett atomkraftmikroskop med en mycket använd metod för att mäta elektriska signaler i celler.
Elektriska impulser spelar en viktig roll i cellerna i människokroppen. Till exempel, neuroner använder dessa impulser för att överföra information längs sina grenar och kroppen använder dem också för att kontrollera sammandragningen av muskler. Impulserna genereras när speciella kanalproteiner öppnar sig i cellernas yttre hölje, låter laddade molekyler (joner) komma in i eller ut ur cellen. Dessa proteiner kallas jonkanaler. Sedan 1970-talet, en metod har varit tillgänglig för forskare som möjliggör mätning av aktiviteten i dessa kanaler, men hittills har denna metod använts främst på celler som inte rör sig. Elektroingenjörer vid ETH Zürich och biologer från universitetet i Bern har nu utvecklat metoden ytterligare, så att de enkelt kan registrera aktiviteten hos rörliga celler, som att slå hjärtmuskelceller i en vävnadsodlingsskål.
Den befintliga metoden innebär att en glaspipett placeras mot det yttre membranet av en cell. Öppningen vid pipettens spets är så liten att den bara berör en bråkdel av cellytan. Helst denna lilla fläck av cellmembran har exakt en jonkanal. Insidan av pipetten är fylld med en ledande vätska och en elektrod, vilket gör det möjligt att mäta skillnader i laddningen mellan den yttre delen av cellen och cellens inre (d.v.s. en elektrisk potential ) och tillfälliga förändringar i denna potential till följd av aktivitet i jonkanalerna. Metoden kallas patch-clamp-tekniken eftersom pipetten används för att klämma fast en lapp av cellmembranet.
Atomkraftsmikroskop med mikroinjektionsnål
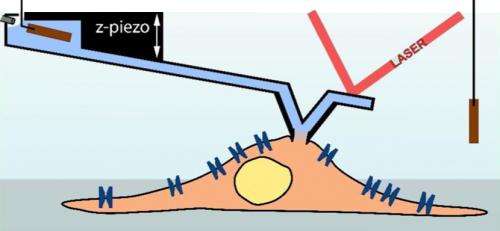
En inspelningsnål för atomkraftmikroskop (ljusblå) fungerar som en pipett för att mäta en cell (ljusbrun; schema). (Illustration:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society) En atomkraftmikroskopregistreringsnål (ljusblå) fungerar som en pipett för att mäta en cell (ljusbrun; schema). Kredit:Ossola D et al. Nano Letters 2015 / Copyright American Chemical Society
Leds av Tomaso Zambelli, en föreläsare vid Institutet för biomedicinsk teknik vid ETH Zürich, och Hugues Abriel, professor vid institutionen för klinisk forskning vid universitetet i Bern, forskarna har nu kombinerat denna teknik med ett atomkraftmikroskop. En sensorspets sitter på ett rörligt fäste - en så kallad cantilever - för att skanna ytan på det mikroskopiska föremålet. Många år sedan, forskarna lyckades producera sensorspetsar med en intern kanal, som möjliggör datorstyrd injektion av molekyler i en cell. Denna teknik marknadsförs nu av ETH spin-off Cytosurge. Dock, forskarna fortsatte utvecklingen av denna teknik genom att förse mikroinjektionsnålen med en elektrod för att utföra patch-clamp-mätningar. Forskarna har nu publicerat de framgångsrika resultaten av denna satsning i tidskriften Nanobokstäver .
Patch-clamp-tekniken är inte bara en central metod för grundforskning inom cellbiologi, utan det används också rutinmässigt vid utveckling av nya läkemedel. Till exempel, läkemedelsindustrin krävs enligt lag som en del av godkännandeprocessen för nya läkemedel för att testa om dessa läkemedel interagerar med jonkanaler. Ett läkemedel som blockerar jonkanaler kan orsaka allvarlig hjärtrytmrubbning hos patienter, som till varje pris bör undvikas.
Längre mätningar och automatisering möjlig
I fallet med den konventionella patch-clamp-tekniken, en operatör placerar pipetten manuellt mot cellen; även om det finns automatiserade rutiner, deras tillämpningar är begränsade. Således, cellerna som testas måste ha samma storlek och form och får inte röra sig (som hjärtceller gör).
När det gäller den nya metoden, mikronålen styrs av en dator som använder kraftmätningar från atomkraftmikroskopet för att hålla den på ett konstant kort avstånd från cellytan. "Detta gör kontakten mellan nålen och cellen mycket mer stabil, vilket gör att vi kan göra mätningar över en längre tidsperiod och till och med testa rörliga celler, " förklarar Zambelli. För första gången, forskare har därmed lyckats mäta elektriska potentialförändringar i jonkanalerna hos bankande hjärtceller. Zambelli säger att han också kan tänka sig att använda detta som en grund för utveckling av en automatiserad metod för att testa vilken cell som helst, oavsett dess form eller storlek.