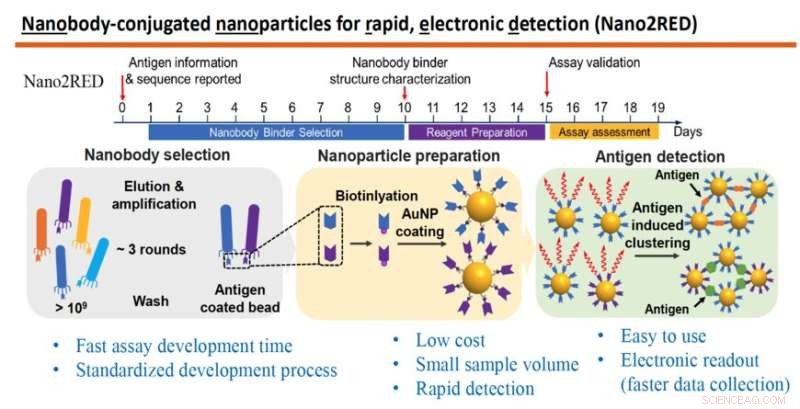
Grafiken framhäver nyckelfunktionerna i Nano2RED, en innovativ diagnostisk metod som uppfunnits av professor Wang och hans kollegor. Den översta delen illustrerar den snabba tidslinjen för steg för produktion av testet, som alla kan utföras på ungefär 20 dagar. Den mittersta delen av grafiken visar de grundläggande stegen. Först produceras ett stort bibliotek av syntetiska antikroppar eller nanokroppar och screenas mot ett känt antigen (vänster), därefter fästs nanokroppar till guldnanopartiklar (mitten) och slutligen detekteras sjukdomsantigener i ett prov när guldnanopartikelbundna nanokroppar smälter samman med dem, vilket ger ett positivt testresultat, (höger). Kredit:Wang lab
Under de senaste åren har dödliga infektionssjukdomar, inklusive ebola och covid-19, dykt upp för att orsaka omfattande mänsklig förödelse. Även om forskare har utvecklat en rad sofistikerade metoder för att upptäcka sådana infektioner, möter befintlig diagnostik många begränsningar.
I en ny studie beskriver Chao Wang, en forskare vid Arizona State Universitys Biodesign Institute och School of Electrical, Computer &Energy Engineering, tillsammans med ASU-kollegor och medarbetare vid University of Washington (UW), Seattle en ny metod för att upptäcka virus som t.ex. Ebolavirus (EBOV) och SARS CoV-2.
Tekniken, känd som Nano2RED, är en smart twist på konventionella högnoggrannhetstest som förlitar sig på komplexa testprotokoll och dyra avläsningssystem. Nanosensorerna i lösning ("Nano2" i namnet) tjänar till att detektera sjukdomsantigener i ett prov genom enkel blandning. Den innovativa Rapid and Electronic Readout-processen ("RED") som utvecklats i Wang-labbet levererar testresultat, som är detekterbara som en färgförändring i provlösningen, och registrerar data genom billiga halvledarelement som lysdioder och fotodetektorer.
Tekniken utgör ett betydande framsteg i kampen mot infektionssjukdomar. Den kan utvecklas och produceras till mycket låg kostnad, distribueras inom veckor eller dagar efter ett utbrott och göras tillgänglig för cirka 1 cent per test.
Jämfört med ofta använda laboratorietester med hög noggrannhet, såsom ELISA, är Nano2RED mycket lättare att använda. Det kräver inte ytinkubation eller tvättning, färgmärkning eller amplifiering, men ger ändå cirka 10 gånger bättre känslighet än ELISA. Dessutom stöder användningen av halvledarenheter ett mycket portabelt digitalt avläsningssystem, som kan utvecklas och produceras till en kostnad så låg som några få dollar, vilket gör den idealisk inte bara för laboratorieanvändning utan för kliniker, hemmabruk och fjärr- eller resursansträngda platser. Detta tillvägagångssätt är baserat på modulära konstruktioner och skulle potentiellt kunna användas för att testa för vilken patogen som helst.
"Den här tekniken fungerar inte för att den är komplex utan för att den är enkel", säger professor Wang. "En annan unik egenskap är biosensingens tvärvetenskapliga natur. En grundläggande förståelse för biokemi, fluidik och optoelektronik hjälpte oss att komma på något så här "enkelt."
Wang är forskare vid Biodesign Center for Molecular Design and Biomimetics vid ASU. Han är också forskare vid ASU:s School of Electrical, Computer and Energy Engineering; och Center for Photonic Innovation. Dr Liangcai Gu är samarbetspartner vid Institutionen för biokemi och Institutet för Proteindesign vid UW, Seattle.
Forskningen visas i det aktuella numret av tidskriften Biosensors and Bioelectronics . Dr. Xiahui Chen och Md Ashif Ikbal från ASU och Dr. Shoukai Kang från UW är de första författarna, och Jiawei Zuo och Yuxin Pan är de andra bidragande författarna.
Testflaskhalsen
Epidemiologer har länge känt till den grundläggande formeln när de konfronteras med ett sjukdomsutbrott. För att identifiera fall och stoppa smittan är det nödvändigt att utveckla ett exakt test eller analys som kan identifiera sjukdomen, sedan testa tidigt och ofta, för att bedöma spridningshastigheten och försöka isolera de infekterade.
Tyvärr, när en ny diagnostik har utvecklats, tillverkats och distribuerats, är sjukdomsutbrottet ofta redan utbrett och utmanande att begränsa. Vidare är noggranna tester, inklusive PCR (som kan förstärka små nivåer av patogena nukleinsyror till mätbara nivåer), ofta dyra, arbetsintensiva och kräver sofistikerade laboratorieanläggningar.
Ebolaepidemin 2014-2016, även om den till stor del begränsades till Västafrika, spred sig med skrämmande hastighet, orsakade panik och dödade mer än 11 000 människor. Virusets dödlighet, en av de högsta för någon känd patogen, kan överstiga 90 %, beroende på sjukdomsstam. Krisen förvärrades av en kombination av otillräckliga övervakningssystem och dålig folkhälsoinfrastruktur.
SARS CoV-2, även om det är mindre dödligt än ebola, har spridit sig till alla länder på jorden och har redan dödat mer än 5,6 miljoner människor världen över. I båda sjukdomsutbrotten kom diagnostiska tester sent på platsen. Vidare har dyra och besvärliga testkrav inneburit att alldeles för få tester har administrerats, även efter deras framgångsrika utveckling.
Den nya studien använder sin innovativa metod för att testa för dessa två framstående sjukdomar som ett bevis på konceptet.
Flodvåg
Ett vanligt drag i många sjukdomsutbrott är blixtens hastighet med vilken en patogen, efter att först ha infekterat en handfull människor, kan ta fart, fläkta ut i alla riktningar och snabbt överväldiga sjukhus och vårdgivare. Cutting off a pathogen's routes of transmission requires identifying and isolating sick individuals through testing, as quickly as possible.
During a pandemic like COVID-19, the sensitivity of a given diagnostic test is secondary to how often the test is given and how long it takes for results to be processed. A highly sensitive test is of limited use if it can only be given once, and results require a weeks-long turnaround. Research has shown that infection outbreaks are best controlled when testing is repeated in less than 3-day intervals and at a large scale.
Adequately preparing society for current and future outbreaks of infectious disease will require faster, cheaper, more accurate and more easily usable diagnostics.
Close affinity
The new technology can identify secreted glycoprotein (sGP), a telltale fingerprint of Ebola virus disease and the SARS-CoV-2 spike protein receptor binding domain (RBD). The technology is highly accurate, rivaling ELISA, a long-recognized gold standard technology for diagnostic testing.
The basic idea of such diagnostics, known as immunoassays, is simple:A sample of blood (or other biological fluid) is applied to the assay, which is adorned with antibodies. When antibodies recognize the presence of a corresponding disease antigen in the sample, they bind with it, producing a positive test result. In the ELISA test, the disease antigen needs to be immobilized on a flat surface.
Nano2RED also relies on binding affinity for positive diagnosis but instead uses floating gold nanoparticles for readout. Unlike ELISA, Nano2RED can be developed from scratch in roughly 10 days and theoretically applicable for any pathogen, providing vitally important early surveillance in the case of a disease outbreak. It can deliver test results in 15-20 minutes and may be administered at an estimated cost of a penny per test. In the current study, the new test was shown to detect Ebola's sGP in serum with a sensitivity roughly 10 times better than ELISA.
Sensing danger
In this method, the first step is to produce a very large library containing over a billion random amino acid sequences, known as nanobodies, which can act as synthetic antibodies, able to bind with target disease antigens. This vast library of nanobodies is then successively screened against the antigen in question, for example, sGP in the case of Ebola. Only those nanobodies that show strong binding affinity for the antigen are used for sensing.
Next, the selected nanobodies are affixed to gold nanoparticles that will act as probes to identify and bind with antigens present in a blood sample. In the study, a pair of two high affinity nanobodies were selected and attached to gold nanoparticles. This approach improves both the sensitivity and specificity of the test.
The key innovation of Nano2RED is the way the antigen detection is registered. As disease antigens in the sample are recognized by the nanobodies, they bind together, forming clusters of bound nanobody and antigen, like islands of algae floating on the sea surface. "Basically, an antigen works like superglue to bring the nanoparticle together," Wang says.
A 'golden' opportunity in the fight against infectious disease
The gold nanoparticles provide a stable platform to hold the nanobodies in place. Once enough binding has taken place, the bound clusters begin to sink to the bottom of the vessel. This can be detected with the naked eye in the form of a color change. The solution becomes lighter in color as the gold-nanoparticle-carried antigen-antibody clusters precipitate out, signaling detection of the pathogen.
While full precipitation of nanoparticle clusters leading to a test result can normally take several hours, the process can be sped up by centrifuging the sample, which eliminates the wait time for precipitation. In this case, just 15-20 minutes are sufficient for a result. "Of course, the gold nanoparticles are heavy, and that helps quick sedimentation, too." Wang added.
Gold nanoparticles also work to display color, not yellow but red, by absorbing light from a narrow spectral range. This absorbance feature allowed the Wang lab to invent a tiny, inexpensive device that converts this color change into an electrical signal, using color-matching semiconductor LEDs and photodetectors. Such instruments produce a rapid and accurate readout of assay results, whose limits of detection are comparable to or better than costly lab-based spectroscopy methods.
The test also delivers quantitative results based on amount of antigen detected. This could be vitally useful for estimating disease severity as well as time elapsed since the infection event. In the future, the test results can be digitized by circuits and conveniently transmitted via internet to anywhere in the world for data analysis and further scrutiny, which could be important to government policy decision-making processes and timely interruption of the transmission.
Nano2RED requires only a tiny blood sample, typically around 20 microliters. "This also makes gold inexpensive in our case, because the mount we need is so tiny," Wang said. Unlike conventional methods, Nano2RED is also very simple to use with minimal training involved for healthcare personnel. It does not require any time-consuming and expensive incubation, washing, fluorescent labeling or amplification.
Future research will help improve the assay's limits of detection even further and modify its detection capacities to include virion particles, extracellular vesicles, small molecules, and nucleic acids.
"There is certainly still a lot to explore," Wang added, "but we so far have a happy marriage between engineering disciplines and biology. And that is what we will continue to work on." + Utforska vidare