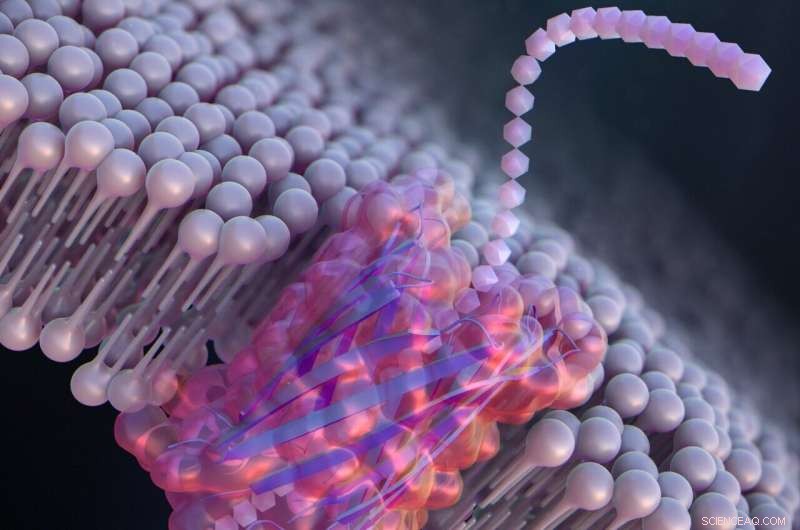
De novo design av en nanopore för enmolekyldetektion som innehåller en β-hårnålspeptid. Kredit:Ryuji Kawano, Tokyo University of Agriculture and Technology
Forskare i Japan har designat de första bottom-up-designade peptiderna, bestående av kedjor av aminosyror, som kan bilda konstgjorda nanoporer för att identifiera och möjliggöra enskild molekyl-sortering av genetiskt material i ett lipidmembran.
Biologiska nanoporer är i allmänhet kanaler gjorda av porbildande proteiner, som kan detektera specifika molekyler, men sådana naturliga kanaler är svåra att identifiera, vilket begränsar föreslagna tillämpningar inom låg kostnad, snabb DNA-sekvensering, småmolekyldetektion och mer.
"Nanopore-avkänning är ett kraftfullt verktyg för etikettfri, enmolekyldetektion", säger motsvarande författare Ryuji Kawano, professor vid Tokyo University of Agriculture and Technology (TUAT) i Japan. "Detta är första gången som DNA och polypeptider kändes av med en de novo-designad nanopor."
De publicerade sina resultat den 22 november i Nature Nanotechnology .
De novo-designade nanoporerna är byggda "från grunden", enligt Kawano, och har potential att efterlikna naturliga proteiner och deras förmåga att upptäcka specifika proteiner. Avgörande, sa Kawano, kan de också konstrueras för att fungera som artificiella molekylära maskiner som kan detektera ett mycket bredare spektrum av molekyler – vilket kan hjälpa till att belysa sambandet mellan struktur och funktion i målproteiner.
"Den veckade strukturen hos proteiner bestäms av deras linjära polypeptidsekvens och ger upphov till specifik proteinfunktionalitet," sa Kawano och noterade att alla proteiner har en unik struktur och storlek. "Den unika primära strukturen är resultatet av strukturell evolution såsom mutation och urval av aminosyrarester över tid. Att avslöja sambandet mellan denna primära information och proteinstruktur är ett av vetenskapens yttersta mål."
För att utveckla stora syntetiska nanoporer som bättre kan detektera och identifiera molekyler för praktiska tillämpningar, designade Kawano och teamet en peptid kallad SV28. Med två armar av aminosyror böjda i en skarp vinkel och specifika laddningar vid änden, kan orienteringen av den hårnålsformade peptiden kontrolleras exakt genom att applicera en spänning. Peptiden kan samlas för att bilda nanoporstrukturer som sträcker sig i storlek från 1,7 till 6,3 nanometer, lämpliga för att detektera DNA-molekyler.
Forskarna modifierade också SV28 genom att lägga till en mutation som får peptidstrukturen att böjas och vridas på specifika sätt. Den resulterande peptiden bildade jämnt fördelade porer på 1,7 nanometer vardera, som kunde detektera en enda polypeptidkedja – eller hälften av ett protein.
Denna prestation skulle kunna användas för att underlätta förståelsen av sambandet mellan proteinstruktur och funktion.
För nästa steg planerar teamet att designa olika peptider och proteiner för att konstruera olika typer av nanoporer för att hjälpa till med peptidsekvensering, fungera som molekylära robotar och mer. + Utforska vidare