Sedan avslöjandet av poly(ADP-ribos)-polymeras (PARP)-hämmare och deras anmärkningsvärda resultat vid behandling av BRCA1/2-mutanta cancerformer, har syntetisk letalitet (SL) i antitumörterapi väckt ökad uppmärksamhet. SL är ett fenomen där en enskild genetisk händelse är otillräcklig för att inducera celldöd, men flera genetiska händelser leder till celldöd.
Karakteriseringen av SL genetiska interaktioner med tumörspecifika mutationer kan användas för att utveckla ett konceptuellt ramverk för att ta itu med "odugliga" mål såsom tumörsuppressorgenen p53. Gallblåscancer (GBC) är den vanligaste maligna tumören i gallsystemet och är vanligtvis dödlig på grund av den begränsade effekten av befintlig behandling.
Det har rapporterats att p53 är en av de mest frekvent muterade generna och en dålig prognostisk markör i GBC. Därför är en SL-baserad strategi för inriktning på p53-muterad GBC ett lovande tillvägagångssätt.
En ny studie om detta ämne ledd av Prof. Mingyu Chen, Prof. Xiujun Cai, Dr. Shjie Li, Dr. Sarun Juengpanich och Dr. Win Topatana, alla från Sir Run-Run Shaw Hospital, Zhejiang University, och Prof. Jicheng Yu vid College of Pharmaceutical Sciences, Zhejiang University visas i Science Bulletin .
Tidigare studier har visat att reparation av DNA-skador som uppnås av WEE1 genom reglering av cellcykelns G2-kontrollpunkt är avgörande för överlevnaden av p53-muterade celler. Därför har adavosertib (ADA), en WEE1-hämmare, en signifikant syntetisk dödlig effekt på p53-muterade cancerformer. Läkemedelsresistens på grund av DNA-skadarespons (DDR) kompensationsvägar och hög toxicitet begränsar dock ytterligare tillämpningar.
Nyligen genomförda studier har visat att användningen av fysikaliska faktorer såsom fotodynamisk terapi (PDT), sonodynamisk terapi (SDT) och gasterapi vid behandling av tumörer har överlägsna effekter och ett bredare användningsområde än konventionella kemiska läkemedel. Fysiska faktorer ger irreversibla förhållanden för att förstärka den syntetiska dödliga effekten av tumördödande kommer att visa sig vara en effektiv strategi.
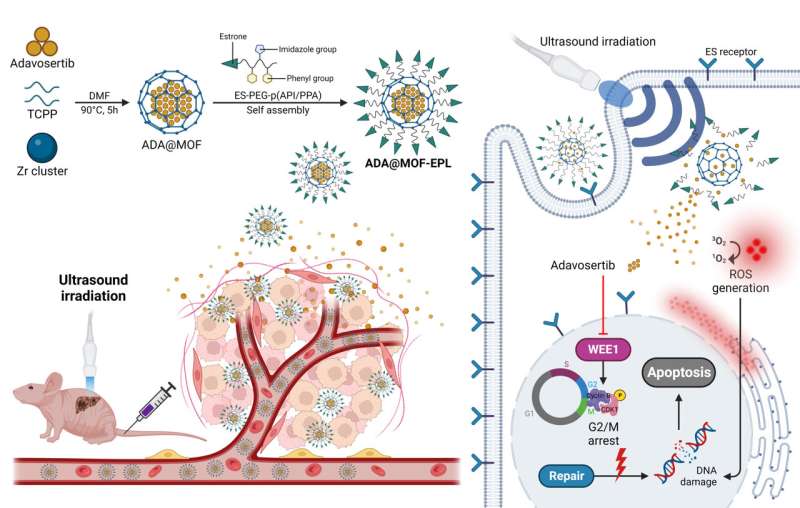
Baserat på MOF-strukturens förmåga att realisera olika ytterligare villkor samtidigt som läkemedel levereras, valde denna nya studie MOF som ett verktyg i samband med SDT för att förbättra den syntetiska dödliga effekten mellan WEE1 och p53 i GBC och fick ett lovande resultat.
Specifikt användes en ljudkänslig porfyrin (tetrakis (4-karboxifenyl) porfyrin, TCPP)-innehållande Zr-MOF som den organiska ryggraden för sonodynamisk terapi (SDT), följt av ADA-inkapsling under MOF-syntesen i en behållare för att öka ADA-belastningen av MOF (ADA@MOF). Vidare belades ytan av ADA@MOF med pH-känsliga östronriktade polymera ligander (EPL) för att ge nanopartiklarna en tumörinriktningsförmåga (ADA@MOF-EPL).
På grund av det höga uttrycket av östrogenreceptorn (ER) i GBC, fungerar östron som en tumörriktad ligand, vilket tillåter nanopartiklar att snabbt och exakt komma in och ackumuleras nära cellkärnan. När de går in i den sura tumörmikromiljön (TME), kommer de försvagade joninteraktionerna mellan ADA@MOF och EPL att lossa dess struktur, vilket leder till den initiala frisättningen av ADA.
Därefter kommer ultraljudsstrålning (US) för att stimulera den ljudkänsliga porfyrininnehållande MOF att resultera i accelererad frisättning av ADA och generera ROS för att skada DNA. Detta kommer att orsaka en högre känslighet hos p53-muterade cancerceller för ADA och undvika läkemedelsresistens på grund av DDR-kompensationsvägar vid källan.
Således skulle den förbättrade syntetiska dödliga effekten mellan ADA och p53 genom ett ytterligare tillstånd av SDT ha en robust tumördödande förmåga. Dessutom minskar nanopartiklarna också kraftigt läkemedlets toxiska reaktion. Viktigast av allt är att denna nya studie erbjuder ett nytt perspektiv på användningen av MOF-baserade läkemedelstillförselsystem vid behandling av olika refraktära cancerformer via förbättrad SL.
Mer information: Shijie Li et al, Adavosertib-Encapsulated Metal-Organic Frameworks for p53-Mutated Gallbladder Cancer Treatment via Synthetic Lethality, Science Bulletin (2024). DOI:10.1016/j.scib.2024.02.039
Tillhandahålls av Science China Press