Optotermiska nanotweezer är en innovativ optisk designmetod som har revolutionerat klassiska optiska tekniker för att fånga ett brett spektrum av nanopartiklar. Även om det optotermiska temperaturfältet kan användas för in situ-reglering av nanopartiklar, kvarstår utmaningar med att identifiera deras potential för att reglera bionanopartiklar.
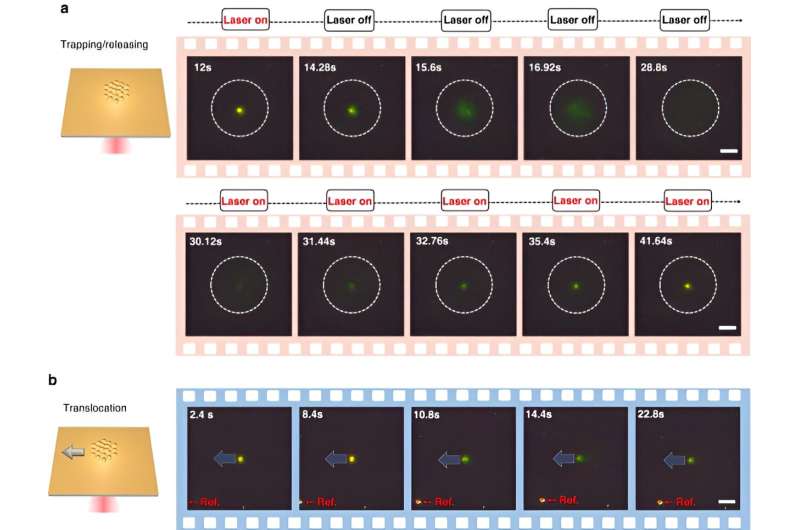
För att observera de synergistiska effekterna av optotermisk manipulation och CRISPR-baserad biodetektion (Clustered Regularly Interspaced Short Palindromic Repeats) utvecklade forskarna en kombination av CRISPR-drivna optotermiska nanotweezers förkortade CRONT.
I en ny rapport i Light:Science &Applications , Jiajie Chen och ett forskarteam inom optoelektronikteknik, biomedicinsk teknik och fysik, åstadkom detta genom att utnyttja diffusiofores och termosmotiska flöden för optotermisk excitation genom att framgångsrikt berika DNA-funktionaliserade guldnanopartiklar, CRISPR-associerade proteiner och DNA-strängar.
Forskarna byggde på ett optotermiskt schema för att förbättra CRISPR-associerad ennukleotidpolymorfismdetektering på singelmolekylnivå, för att introducera en ny CRISPR-baserad metod för att observera nukleotidklyvning. Forskarna studerade detta innovativa tillvägagångssätt som ett universellt område för diagnostik, biofotonik och bionanoteknik.
1986 uppfann Arthur Ashkin en optisk pincett för att fjärrreglera nanoobjekt och fick ett Nobelpris i fysik 2018 för denna banbrytande upptäckt och bidrag till biologiska system. Medan en klassisk optisk pincett är beroende av ljusets momentumtransformation, har tvärvetenskapliga kombinationer över plasmonisk optik, elektriskt fält och temperatur effektivt åtgärdat gränserna.
En mängd olika innovativa tillvägagångssätt har dykt upp för att erbjuda nya möjligheter inom partikelanalys och reglering. Optotermiska nanotweezers använder optiskt inducerade termodynamiska krafter för att reglera nanopartiklar i mikronskalan med submikrons precision.
Jämfört med traditionell optisk pincett kräver optotermisk pincett en lägre effekttäthet, vilket gör dem till ett attraktivt alternativ för biologisk detektion, samtidigt som de minskar negativa optiska effekter på biologiska prover. Eftersom termiska effekter spelar en nyckelroll under en mängd olika biologiska processer är det möjligt att utnyttja temperaturfältets kapacitet för praktiska tillämpningar.
Metoden kan användas för att reglera bionanopartiklar som sträcker sig från mikro- till nanoskala till att inkludera bakterier och levande celler, såväl som enkel- och dubbelsträngade DNA-molekyler och proteiner.
Kombinerar CRISPR med nanotweezers – CRONT
Det klustrade, regelbundna korta palindromupprepningssystemet (CRISPR) erbjuder i sig ett anmärkningsvärt genredigeringsverktyg, som också fick ett Nobelpris 2020. Metoden bestod av ett CRISPR-associerat nukleasprotein och ett mål-DNA-specifikt guide-RNA.
Biofysiker och bioingenjörer är allt mer angelägna om att förbättra känsligheten och mångsidigheten för DNA-detektion genom att kombinera CRISPR-Cas-systemet med nya avkänningslägen.
För att övervinna de befintliga gränserna för metoden designade Chen och kollegor en universellt användbar optotermisk pincettplattform känd som CRISPR-drivna optotermiska nanotweezers för att identifiera bionanopartiklar och använde uppsättningen för att identifiera in situ DNA-molekyler, utan nukleinsyraamplifiering. Experimenten gav ultralåga detektionsvolymer vid 10 μL för att identifiera enstaka nukleotidpolymorfismer för att studera genetisk mångfald, sjukdomskänslighet och läkemedelsrespons, för att möta framtida krav från genomisk forskning och medicin.
För att möjliggöra CRONT (CRISPR-drivna optotermiska nanotweezers), designade forskarna en mikrofluidkammare med ett tunt lager av guldfilm avsatt på täckglaset. När teamet bestrålade guldfilmen med laserbelysning genererade de ett temperaturfält som omgav laserfläcken. Forskarna detaljerade de optimala förhållandena för CRISPR-reaktioner och initierade klyvningen av DNA-guld nanofilmkonjugatet med hjälp av mörkfältsmikroskopi.
De tillsatte en nonjonisk polymer av polyetylenglykol (PEG) i vattenlösningen som ett biologiskt ytaktivt ämne för utmärkt biokompatibilitet.
Närvaron av flera nanopartiklar och deras varierande termoforetiska rörlighet genererade en distinkt koncentration av lösta ämnen. När lösta ämnen med ökade koncentrationer påverkade de med lägre koncentrationer genom osmotiskt tryck, resulterade resultaten i en interaktion som kallas diffusioforetisk kraft. Denna systematiska undersökning visade på potentialen för CRONT att inkluderas för att utföra biomolekylär identifiering.
Optotermiskt kombinerar proteiner och DNA
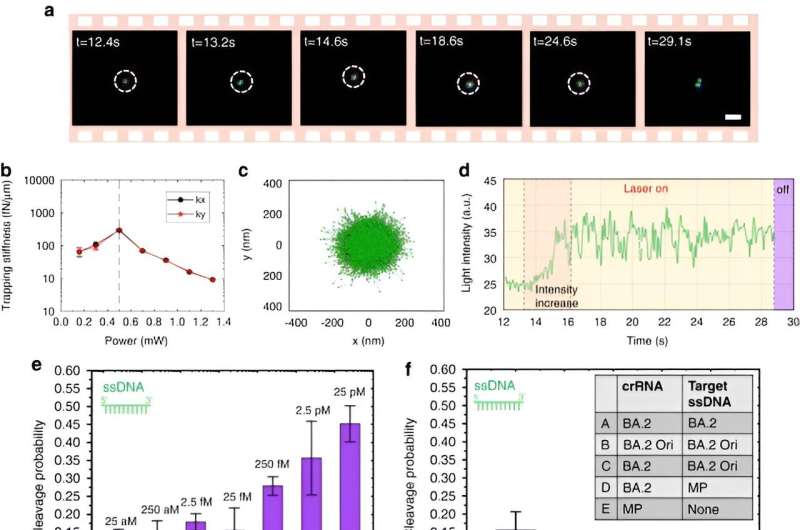
För att möjliggöra CRISPR-drivna optotermiska nanotweezers studerade Chen och kollegor aggregationsbeteendet hos proteiner och DNA genom att använda fluorescensmärkning där längden på den stela stammen genererade en polyetylenglykolkoncentrationsgradient. Medan en högre lasereffekt inte kontinuerligt ökade ackumuleringshastigheten på grund av ett förstorat termosmotiskt flöde, var ackumuleringen av enkelsträngat DNA högre än dubbelsträngat DNA. Medan proteinansamlingar sällan studeras inom biofysik, visade de fluorescensmärkta Cas12a-proteinerna en tendens att bilda ringa ringliknande ansamlingar, där ökad lasereffekt ökade deras ackumuleringshastighet.
Teamet utförde dessutom experiment på vanligt införlivade proteiner som bovint serumalbumin med FITC-märkning. I närvaro av ett optotermiskt fält förblev denna proteinfördelning slumpmässig och opåverkad av närvaron av polyetylenglykolmolekyler.
Chen och teamet noterade hur det optotermiska fältet förknippat med CRISPR-drivna optotermiska nanotweezer (CRONT), gav en lämplig temperatur för CRISPR-baserad biodetektion, med kapacitet att berika bionanopartiklar för att detektera DNA i ultralåga koncentrationer, istället för enbart Brownsk rörelse, dvs. styrs genom detektering av diffusion.
Forskarna inkluderade CRISPR-12a-schemat för att undersöka enkelsträngat omgivande DNA. CRONT-systemet identifierade framgångsrikt DNA på enmolekylnivå för enstaka nukleotidpolymorfismer med hög känslighet och specificitet.
På detta sätt införlivade Jiajie Chen och kollegor diffusiofores och termosmotiska flöden i gränsskiktet av en optotermiskt känslig film för att visa en ny metod för att reglera CRISPR-drivna optotermiska nanotweezers i nanoskala.
Denna metod möjliggjorde en omedelbar implementering av CRISPR-baserad biosensing med en ultralåg detektionsvolym.
Optisk pincett är utrustad med DNA-identifiering genom CRISPR-baserade biosensorsystem som en väg för biomolekylberikning för att klyva CRISPR-komplexet. Sådana CRISPR-drivna optotermiska nanotweezer eller CRONT-system har enorma löften att främja förståelsen av komplexa biologiska processer som en mångsidig detektionssond inom biomedicinsk forskning, läkemedelsupptäckt och sjukdomsdiagnostik.
Mer information: Jiajie Chen et al, CRISPR-drivna optotermiska nanotweezers:Diverse bio-nanopartikelmanipulation och identifiering av enstaka nukleotider, Light:Science &Applications (2023). DOI:10.1038/s41377-023-01326-9
Journalinformation: Ljus:Vetenskap och tillämpningar
© 2023 Science X Network