
Konstnärlig representation av ett membran med inbäddade proteiner:ETH Zürich-forskare har utvecklat en metod som kommer att ge impulser till den strukturella belysningen av sådana molekyler. Kredit:www.colourbox.com
ETH-forskare har utvecklat en ny metod för att kristallisera stora membranproteiner för att bestämma deras struktur. Detta kommer att vara till nytta för biologisk forskning och läkemedelsindustrin.
Membraninbäddade proteiner är en viktig del av celler och alla former av liv. De finns inte bara i många olika varianter, men också utföra ett brett utbud av funktioner, allt från intracellulär kommunikation och transport av ämnen in i eller ut ur cellen till att mediera immunsvaret. Membranproteiner anses vara viktiga terapeutiska och diagnostiska målstrukturer. Om deras struktur och funktioner är kända, läkemedelsforskare kan utveckla aktiva substanser som påverkar dessa funktioner målinriktat.
Tills nu, dock, Att klargöra strukturen hos membranproteiner har varit mycket svårt eftersom det först kräver att forskare isolerar ett stort antal av dessa molekyler och bildar kristaller från dem. Däri ligger svårigheten:membranproteiner är olösliga i vatten och ofta för stora och heterogena för att kunna kristalliseras med standardmetoderna.
Nu, gruppen ledd av Raffaele Mezzenga, Professor i mat och mjuka material vid ETH Zürich, arbetar för att eliminera denna begränsning. I en publikation i tidskriften Naturkommunikation , gruppen presenterar en generell metod, som kan användas för att kristallisera membranproteiner av vilken typ eller storlek som helst.
Lipid-vattenblandning som reaktionskammare
Grunden för den nya metoden lades på 1990-talet med metoden som kallas "in meso crystallization":proteinerna isoleras och koncentreras med hjälp av stabila vatten-lipidblandningar som kallas lipidmesofaser. I mesofaser av detta slag, en självmonteringsprocess leder till ett tredimensionellt nätverk av böjda vattenkanaler vars väggar består av lipider, som i ett biomembran. Dessa vattenkanaler har vanligtvis en diameter på 3-4 nanometer, och nätverkets kubiska grundmotiv upprepas med jämna mellanrum.
I kanaler av detta slag, membranproteinerna bäddar in sig i väggarna med hjälp av den hydrofoba delen som annars sitter i cellmembranet. Resten av proteinet hamnar i vattenkanalens inre, och proteinerna, en gång korrekt rekonstituerad, kan sedan börja kristallisera. Det är just för att kanalerna erbjuder så lite utrymme som tidigare, endast små membranproteiner kunde kristalliseras – stora proteiner krossades ut och bildade inga kristaller.
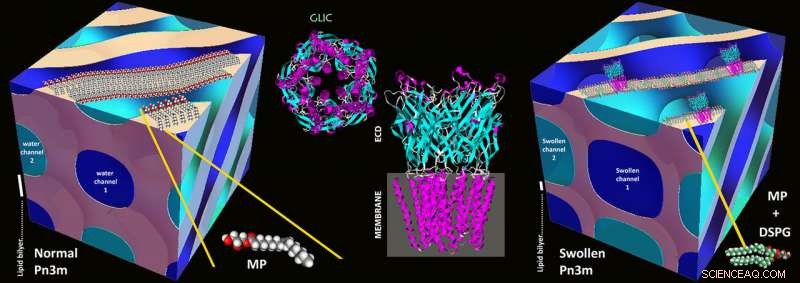
Schematiska illustrationer av en normal Pn3m kubisk mesofas bestående av MP:vatten (vänster), GLIC-proteinstruktur (mitten), och i mesokristallisation av GLIC-protein i en mycket svullen Pn3m kubisk mesofas bestående av DSPG:MP:vatten (höger). Kredit:Zabara A et al, Nat.Comm., 2018
Kanaler expanderade med laddade lipider
ETH-forskarna har nu använt ett knep för att utöka kanalerna:de blandade in en liten andel elektriskt laddade lipider med lipiderna. Dessa stöter bort varandra och blåser på så sätt upp kanalerna, öka deras diameter till 20 nanometer. Även om de första försöken att elektrostatiskt svälla vattenkanaler i lipidmesofaser går tillbaka till början av 2000-talet och har fortsatt stadigt tills nyligen, detta är den första påvisade utvecklingen av denna strategi till en metodik av allmän betydelse.
Tack vare dessa svullna lipidmesofaser, verkligen, Mezzenga och hans kollegor lyckades kristallisera stora membranproteiner och sedan belysa deras struktur.
ETH-forskarna praktiserade på membranproteinet som kallas GLIC (Gloeobacter ligand-gated ion channel), som kommer från bakterier. GLIC har flera stora underenheter som ligger utanför bakteriemembranet i den yttre delen av cellen. Förr, en annan metod användes för att kristallisera detta komplex eftersom dessa domäner var för stora. "Vår procedur förbättrade inte bara kristalliseringen, men producerade också extremt kompakta kristaller som tillhör en ny kristallografisk grupp för detta protein, " säger Mezzenga. Dessutom, forskarna kunde kristallisera detta kanalprotein i dess stängda konfiguration för första gången. Tills nu, forskare kunde kristallisera komplexet endast i dess öppna tillstånd med en annan metod.
Boost förväntas för strukturell belysning
Den nya "generaliserad i meso"-metoden kommer sannolikt att vara av stort intresse för i synnerhet strukturbiologer, som hittills har kämpat för att belysa strukturen hos stora membranproteiner. "Detta verktyg kommer att ge ny impuls till strukturell belysning, eftersom det öppnar upp proteiner som tidigare var utom räckhåll, säger Mezzenga.
För närvarande, forskare känner till den exakta strukturen av endast 360 små membranproteiner, eller ungefär en sjundedel av alla membranproteiner. Strukturen för de många återstående membranproteinerna är okänd.
Enligt Mezzenga, forskningen kan också vara till nytta för läkemedelsindustrin. "Förmågan att bestämma struktur är av största vikt för utvecklingen av nya läkemedel, ", säger han. "Denna metod kommer att göra det avsevärt enklare och ge ny fart på området."