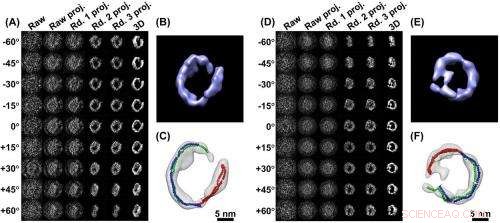
3D-bilder från en enda partikel (A) en serie bilder av en ApoA-1-proteinpartikel, taget från olika vinklar som anges. En följd av fyra datorförbättringar (projektioner) förtydligar signalen. I den högra kolumnen är 3D-bilden sammanställd från de förtydligade data. B) är en närbild av den rekonstruerade 3D-bilden. C) Analys visar hur partikelstrukturen bildas av tre ApoA-1-proteiner (rött, grön, blå nudelliknande modeller)
(PhysOrg.com)-När Gang Ren virvlar runt kontrollerna i sitt kryo-elektronmikroskop, han jämför det med att finjustera växellådan och bromsarna på en racercykel. Men den här maskinen vid US Department of Energy (DOE) s Lawrence Berkeley National Laboratory (Berkeley Lab) är lite mer komplex. Det kostar nästan 1,5 miljoner dollar, fungerar vid kyltemperaturen för flytande kväve, och det gör det möjligt för forskare att se vad ingen har sett förut.
På Molecular Foundry, Berkeley Labs hyllade forskningscenter för nanoteknik, Ren har drivit sitt Zeiss Libra 120 Cryo-Tem-mikroskop till resolutioner som aldrig hade tänkts av dess tyska tillverkare, producera detaljerade ögonblicksbilder av enskilda molekyler. I dag, han och hans kollega Lei Zhang rapporterar de första 3D-bilderna av ett individuellt protein som någonsin erhållits med tillräckligt tydlighet för att bestämma dess struktur.
Forskare skapar rutinmässigt modeller av proteiner med röntgendiffraktion, Nukleär magnetisk resonans, och konventionell cryo-elektronmikroskop (cryoEM) avbildning. Men dessa modeller kräver dator "genomsnitt" av data från analys av tusentals, eller till och med miljontals liknande molekyler, eftersom det är så svårt att lösa egenskaperna hos en enda partikel. Ren och Zhang har gjort just det, generera detaljerade modeller med elektronmikroskopiska bilder av ett enda protein.
Han kallar sin teknik för "individuell partikel elektron tomografi, ”Eller IPET. Arbetet beskrivs i 24 januari -numret av PLoS One , vetenskaplig tidskrift med öppen källkod, i en artikel med titeln "IPET och FETR:Experimental Approach for Studering Molecular Structure Dynamics by Cryo-Electron Tomography of a Single-Molecule Structure."
De 3D-bilder som rapporteras i tidningen inkluderar de av en enda IgG-antikropp och apolipoprotein A-1 (ApoA-1), ett protein som är inblandat i mänsklig metabolism. Rens mål är att producera individuella 3D-bilder av medicinskt signifikanta proteiner, såsom HDL-det hjärtskyddande "goda kolesterolet" vars struktur har undvikit ansträngningar från legioner av forskare beväpnade med mycket kraftfullare proteinmodelleringsverktyg. ”Vi är på god väg, Säger Ren.
Ren har meriter från en som vet vad han kan göra. Han rekryterades för att arbeta på Berkeley Lab i augusti 2010 från University of California i San Francisco, där han hade använt ett kryo-elektronmikroskop och mer konventionella genomsnittstekniker för att urskilja 3D-strukturen för LDL-det "dåliga kolesterolet" tros vara en stor riskfaktor för hjärtsjukdomar.
Hans bilder av enstaka proteiner är lite suddiga, även efter att de städats genom komplex datorfiltrering, men mycket informativ för den utbildade observatören. Dessa individuella partiklar är utomordentligt små, kräver att Ren nollställer på en plats på mindre än 20 nanometer. Han har rapporterat proteinbilder så små som 70 kDa. Det är kilodalton, en lilliputisk skala (uttryckt i massenheter) avsatt för att mäta atomen, molekyler, och utdrag av DNA. Det är ett mer användbart sätt att storleksanpassa mjuka föremål som proteiner som kan klumpas ihop, trådig, eller diskett.
Till skillnad från de skulpturala bilderna av proteinmodeller, en svit av dessa fotografier kan förmedla en känsla av dessa partiklar i all sin nanoskala diskett. Inom den komplexa strukturen för dessa proteiner ligger hemligheterna för deras funktion, och kanske nycklar till droger som blockerar de dåliga och främjar de goda. Med ytterligare datorfiltrering, en högkontrastmodell av protein kan genereras från bilderna och animeras för att visa dess rörliga delar i 3D.
"Detta låter dig se personligheten hos varje protein, Säger Ren. "Det är ett bevis på konceptet för något som folk trodde var omöjligt."
Genom att observera strukturen hos enstaka proteiner, det är möjligt att förstå deras flexibla, rörliga delar. ”Detta öppnar en dörr för studier av proteindynamik, Säger Ren. "Antikroppar, till exempel, är inte fasta. De är mycket flexibla, väldigt dynamiskt. ”
Hur fick Ren så mycket mångsidighet ur sin Vågen 120? "Det är inte en mycket avancerad modell, ’Medger han. Mycket har att göra med tillbehören han skruvar fast på maskinen, och med sin egen konstnärlighet och tålamod. Han har utrustat mikroskopet med 300 dollar, 000 CCD -kamera, några kraftfulla bildbehandlingsprogram, speciella kontrastmedel, och en enhet som kallas ett "energifilter" som siktar genom digitaliserad kameradata och släpper ut svaga signaler. Grundligt förtrogen med sin anpassade maskin, han använder också ett element av armbågsfett, arbetar långa timmar för att få fram de kraftfulla bilderna från en ström av digitalt brus.

Personalvetaren Gang Ren (stående) och är postdoc-kollegan Lei Zhang kan kontrollera bilder av enskilda proteiner från deras kryo-elektronmikroskop vid Berkeley Labs Molecular Foundry.
De många vinklarna som används för att skapa 3D-porträttet hjälper till att lösa den svaga molekylära bilden. "Alla bilder är bullriga, ”Förklarar Ren. "Inom fysiken, bullret är inkonsekvent bland bilderna, men signalen - objektet eller proteinet - är konsekvent. Genom att använda detta tillvägagångssätt, vi finner att den konsekventa delen (signalen) kan förbättras, medan den inkonsekventa delen (bruset) kommer att reduceras avsevärt. ”
Elektronmikroskop fokuserar strömmar av elektroner snarare än ljus för att se otroligt små saker. Den korta våglängden hos en elektronstråle möjliggör mycket högre upplösning och förstoring än synligt ljus. Kraftfulla elektronmikroskop har använts i decennier för att sondera material i atomskala; och alldeles intill Molecular Foundry ligger Berkeley Labs nationella centrum för elektronmikroskopi, som rymmer de mest kraftfulla mikroskop i världen. TEAM 0.5 -mikroskopet kan skilja objekt så små som radien för en väteatom. Men dessa tungviktiga mikroskop drar upp denna atomskalaupplösning med energipulser som skulle utplåna de flesta mjuka biologiska proteiner. Elektronmikroskopen med hög effekt används främst för att sondera atomstrukturen med starka, fasta material, till exempel grafen - ett kolstycke som bara är en atom tjockt.
Rens laboratorium specialiserar sig på cryoEM, som undersöker objekt frusna vid -180 ° C (-292 ° F). Ett bad med flytande kväve fryser prover så snabbt att inga iskristaller bildas. ”Det är amorft, som glas, Säger Ren. Proteinproverna fryses på en skiva som är stor som barnets nagel, fylld med små brunnar 2 mikron över. Skivan sätts in i mikroskopet på ett roterande stöd som kan luta provet upp till 140 ° inuti ett vakuum-tillräckligt med kameravinklar för att producera ett 3D-perspektiv. ”Utmaningen är att isolera det från luften, och för att vända den utan vibrationer, även vibrationerna från bubblan av flytande kväve, Säger Ren.
Den extremt låga temperaturen fixerar proverna och förhindrar att de torkar ut i det vakuum som behövs för elektronskanningen. Det skapar förhållanden som är gynnsamma för avbildning vid mycket lägre doser av elektroner-tillräckligt låga för att hålla ett enda mjukt protein intakt medan mer än 100 bilder tas under en till två timmars period.