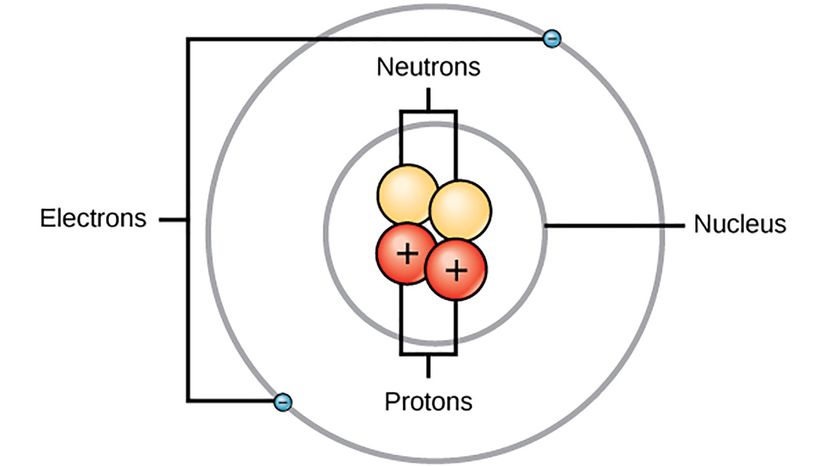
 Bohrs modell av atomen. Wikimedia Commons (CC BY 4.0)
Bohrs modell av atomen. Wikimedia Commons (CC BY 4.0) Du kan söka efter en bild av en atom på internet så hittar du en, även om ingen faktiskt sett en atom förut. Men vi har en uppskattning av hur en enda atom ser ut på grund av arbetet från ett gäng olika forskare som danska fysikern Niels Bohr.
Atomer är materiens byggstenar - en enda atom av varje enskilt element är den mest grundläggande enheten i naturen som fortfarande följer de fysikregler som vi kan observera i vardagen (de subatomära partiklarna som bildar atomer har sina egna särskilda regler) . Forskare misstänkte atomer existerade länge innan de kunde konceptualisera sin struktur - även de gamla grekerna ansåg att universums materia bestod av så små komponenter att de inte kunde brytas ner till något mindre, och de kallade dessa grundläggande enheter atomos , vilket betyder "odelat". I slutet av 1800 -talet, man förstod att kemiska ämnen kunde brytas ner till atomer, som var mycket små och atomer av olika grundämnen hade en förutsägbar vikt.
Men då, 1897, Brittiska fysikern J.J. Thomson upptäckte elektroner-negativt laddade partiklar inuti atomerna som alla hade tillbringat större delen av ett sekel och trodde var helt odelbara-som de minsta sakerna som fanns. Thomson antog precis att elektroner fanns, men han kunde inte räkna ut exakt hur elektroner passar in i en atom. Hans bästa gissning var "plommonpuddingmodellen, "som avbildade atomen som en positivt laddad paj översållad med negativt laddade områden utspridda som frukt i en gammaldags dessert.
"Elektroner befanns vara negativa elektriska, och alla med samma massa och mycket små jämfört med atomer, "säger Dudley Herschbach, en Harvard -kemist som delade Nobelpriset i kemi 1986 för sina "bidrag om dynamiken i kemiska elementära processer, "i ett mejl." Ernest Rutherford upptäckte kärnan 1911. Kärnor var positiva elektriska, med olika massor men mycket större än elektroner, men ändå väldigt liten i storlek. "
Niels Bohr var Rutherfords student som spelade över hans mentors projekt för att dechiffrera atomens struktur 1912. Det tog honom bara ett år att komma med en fungerande modell av en väteatom.
"Bohrs modell från 1913 för väteatomen hade cirkulära elektronbana kring protonen - som jordens banor runt solen, "säger Herschbach." Bohr hade använt ett enkelt och regelbundet mönster för väteatomens spektrum, som hade hittats av Johann Balmer 1885. Han använde också idén om kvantidén, hittades av Max Planck år 1900. "
År 1913, Bohrs modell var ett stort steg framåt eftersom den införlivade egenskaper hos den nyfödda kvantmekaniken i beskrivningen av atomer och molekyler. Det året, han publicerade tre papper om konstitutionen av atomer och molekyler:Den första och mest kända ägnades åt väteatomen och de andra två beskrev några element med fler elektroner, använda sin modell som ram. Modellen han föreslog för väteatomen hade elektroner som rör sig runt kärnan, men bara på speciella spår med olika energinivåer. Bohr antog att ljus sändes ut när en elektron hoppade från ett högre energispår till ett lägre energispår - det var det som fick väte att lysa i ett glasrör. Han fick väte rätt, men hans modell var lite glitchy.
"Modellen misslyckades med att förutsäga det rätta värdet av jordtillståndsenergierna för många elektronatomer och molekylernas bindningsenergier-även för de enklaste 2-elektronsystemen, såsom heliumatomen eller en vätemolekyl, säger Anatoly Svidzinsky, en professor vid Institute for Quantum Science and Engineering vid Texas A&M, i en e -postintervju. "Så, redan 1913, det var klart att Bohrs modell inte är helt korrekt. Även för väteatomen, Bohrs modell förutspår felaktigt att atoms grundtillstånd har orbital vinkelmoment utan noll. "
Som, självklart, kanske inte är så vettigt för dig om du inte är kvantfysiker. Dock, Bohrs modell var snabbspårad för att få ett nobelpris i fysik 1922. Men även när Bohr cementerade sitt rykte i fysikens värld, forskare förbättrade sin modell:
"Bohrs modell för väteatomen förbättrades av Arnold Sommerfeld 1916, "säger Herschbach." Han hittade elliptiska banor som stod för spektralinjer i närheten av dem som hade kommit från cirkulära banor. Bohr-Sommerfeld-modellen för väteatomen är grundläggande, men kvantitet och relativitet blev stora aspekter. "
Mellan 1925 och 1928, Werner Heisenberg, Max Born, Wolfgang Pauli, Erwin Schrodinger och Paul Dirac utvecklade dessa aspekter långt bortom Bohrs atommodell, men hans är den klart mest kända modellen för en atom. Atommodellerna kvantfysik har gett oss att se mindre ut som en sol omgiven av elektronplaneter och mer som modern konst. Det är troligt att vi fortfarande använder Bohr -modellen eftersom det är en bra introduktion till begreppet atom.
"År 1913, Bohrs modell visade att kvantisering är en rätt väg att gå i beskrivningen av mikrovärlden, "säger Svidzinsky." Alltså, Bohrs modell visade forskare en riktning att söka och stimulerade vidare utveckling av kvantmekanik. Om du känner till vägen, förr eller senare hittar du rätt lösning på problemet. Man kan se Bohrs modell som en av riktningsskyltarna längs en vandringsled in i kvantvärlden. "
Nu är det intressantNiels Bohrs far, Christian Bohr, nominerades till tre olika nobelpris i medicinens fysiologi, även om han aldrig vann.