 Vad skulle Paul Cezanne göra av det fruktstilleben som produceras av mikrober? Felix Moser (MIT)
Vad skulle Paul Cezanne göra av det fruktstilleben som produceras av mikrober? Felix Moser (MIT) Bakterier som reagerar på rött, grönt och blått ljus har producerat några slående trefärgade konstverk som har gjort rundorna online, men bidraget de ger till syntetisk biologi är ännu mer imponerande.
De konstnärliga bakterierna konstruerades av Chris Voigt, professor i biologisk teknik vid Massachusetts Institute of Technology, och hans team, som vill programmera celler för att utföra funktioner och även bygga material nedifrån och upp.
"Celler är otroliga atomarkitekter. De kan bygga mycket exakta material som du inte kan göra med kemi, "Voigt säger." Och du kan göra det under omgivande förhållanden istället för att använda giftiga lösningsmedel. "De publicerade sin studie i veckan i Nature Chemical Biology.
Konstruerade bakterier kan vara till hjälp för oss på alla möjliga sätt. De kan utformas för att bygga vävnad eller material, eller identifiera sjukdom hos en patient och administrera en exakt dos medicin till rätt plats. De kan svärma rötterna till en växt i jorden och leverera en exakt mängd gödselmedel. De kan producera järnpartiklar när de växer, som kan bli komponenter i elektronik som är en hybrid av biologi och maskin.
För att inse den framtiden, forskare måste bli bättre på att programmera celler. Det är där den senaste tekniken, kallas ett RGB -system - för rött, grönt och blått - kommer in. Det bygger på mer än ett decennium av forskning i Voigts laboratorium, särskilt, ett projekt han publicerade 2005, som beskrev ett sätt att få Escherichia coli bakterier för att skapa svartvita foton.
2005-svartvita systemet bestod av fyra gener, 4, 000 baspar (CG- och AT-baserna i en dubbelsträngad molekyl), och tre bitar av DNA som kallas promotorer som initierar den första åtgärden en gen vidtar för att förvandla dess instruktioner till en produkt, såsom ett protein.
Saker och ting har blivit mer komplicerade sedan dess.
Teamets RGB -system består av 18 gener, 14 promotorer, liksom andra bitar av DNA som kallas terminatorer och plasmider, och 46, 198 baspar.
"På ett sätt, det går från en ljusvåglängd till tre, men för att du gör det inuti cellen, det blir exponentiellt svårt att få många saker att fungera bra, och det krävde mycket teknik, "Säger Voigt.
Tekniken för att programmera cellerna inkluderade optogenetik (ett sätt att kontrollera celler med ljus) ett programmeringsspråk för celler som heter Cello som Voigt och hans team utvecklade förra året och en ny metod för att kontrollera genfunktioner som kallas CRISPR.
Med hjälp av dessa och andra verktyg från syntetisk biologi, de designade en cell med följande delar:
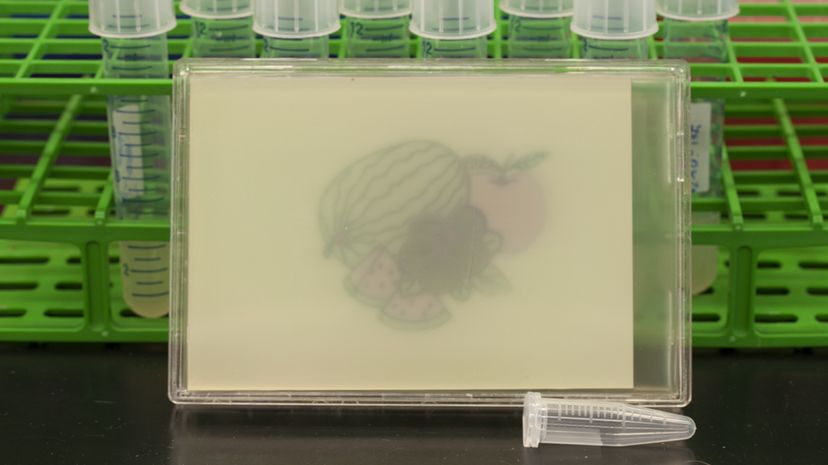
Cellen kunde känna ljusets tre färger, bearbeta informationen med de genetiska kretsarna och, eftersom forskarna kunde kontrollera vad generna gjorde med informationen - hur de uttryckte det - genererade cellerna röda, grön, och blått pigment.
I en petriskål, mikroberna "målade" ett fruktstilleben, ett geometriskt ödelmotiv och ett hoppande Super Mario.
Eftersom forskarna kontrollerar genuttryck, de kunde använda lamporna för att göra andra saker förutom att göra konst. I ett test, forskarna kontrollerade cellens förmåga att producera acetat. Att förstå återkopplingssystemet för acetat är avgörande för många industriella processer, som att göra smakämnen, lösningsmedel och bränslen, där ingenjörer i vissa fall vill ha acetatet men i andra fall, de kanske inte.
Voigt säger att RGB -systemet också kan användas för att bygga molekyler, en process som kräver specifika uppsättningar av reaktioner att inträffa vid särskilda tidpunkter. Att tända och släcka lamporna vid specifika tider kan utlösa metaboliska vägar och enzymer i rätt ögonblick för att göra naturliga sötningsmedel och läkemedel.
Och eftersom dessa celler styrs av ljus, de kunde fjärrstyras.
För nästa projekt, Voigt skulle vilja bygga en större, mer komplext system. Men han och hans team vet att det kommer att bli en utmaning. Det visar sig att när de tillsatte många genetiska komponenter till cellen, de annars icke -toxiska delarna började hindra cellens tillväxt och i vissa fall, döda dem.
"Vad är det med systemets design som gör det svårt för cellen att fungera korrekt?" Frågar Voigt.
Att hitta svaret kan innebära lite kreativitet.