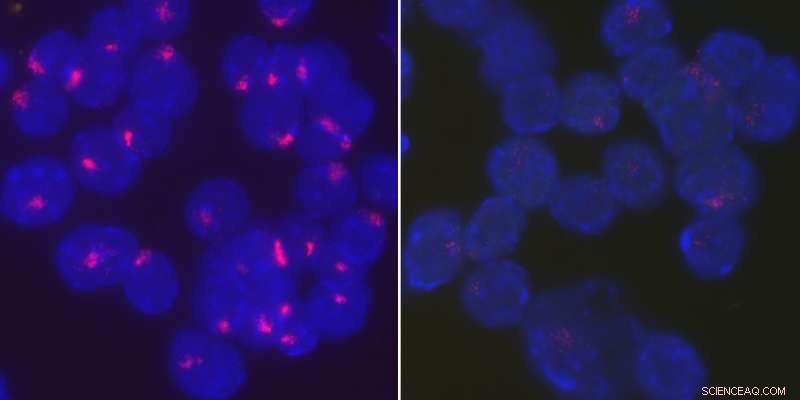
Forskare fann att proteinet YY1 för Xist RNA tillbaka till den inaktiva X-kromosomen för att upprätthålla X-kromosominaktivering i stimulerade B-celler. Aktiverad, vildtyp B-celler från honmöss lokaliserar Xist RNA tätt vid sina inaktiva X-kromosomer (vänster), medan Xist RNA blir dispergerat genom hela kärnan när YY1 raderas (höger). Kredit:University of Pennsylvania
Autoimmuna sjukdomar tenderar att drabba kvinnor mer än män och att ha flera X-kromosomer kan vara den främsta anledningen till detta. Medan en process som kallas X-kromosominaktivering tjänar till att balansera ut gendosering mellan män och kvinnor, vissa gener på den "inaktiva X"-kromosomen i immunceller kan ibland undkomma denna process, ge kvinnor en extra dos av immunitetsrelaterat genuttryck.
I en ny studie, ett team från University of Pennsylvania beskriver hur X-kromosominaktivering regleras i immunsystemets B-celler när de utvecklas i benmärgen och när de möter antigener. Deras arbete belyser en dynamik, tvåstegsmekanism hos kvinnor där B-celler som saknar markörerna för X-kromosominaktivering återfår dessa modifieringar under B-cellsaktivering, i en process som involverar transkriptionsfaktorn YY1.
"Det som är anmärkningsvärt är att B-celler är de som gör antikroppar och autoantikroppar, så de är verkligen avgörande för både skyddande immunsvar och autoimmunitet, sade Montserrat C. Anguera, biträdande professor vid institutionen för biomedicinska vetenskaper vid Penns School of Veterinary Medicine och seniorförfattaren på studien. "En stor fråga som återstår är, Varför startar dessa immunceller för att denna kromosom ska regleras annorlunda och även, Om dessa processer går fel, hur leder det till autoimmunitet och förlust av självtolerans?"
Studien, publiceras i PLOS Genetik , leddes av Camille M. Syrett, en doktorand i Angueras labb. Medförfattare, representerar både Penn Vet och Penn's Perelman School of Medicine, var Vishal Sinhava, Suchita Hodawadekar, Arpita Myles, Guanxiang Liang, Yue Zhang, Satabdi Nandi, Michael Cancro och Michael Atchison.
I en studie förra året i tidskriften Förfaranden från National Academy of Sciences , Anguera och kollegor fann det naivt, ostimulerade kvinnliga lymfocyter, immunsystemets B- och T-celler, misslyckades med att helt inaktivera en X-kromosom. Forskningen visade att detta berodde på att Xist, ett långt icke-kodande RNA-transkript väl känt för att initiera och upprätthålla processen för X-kromosominaktivering, misslyckades med att lokalisera till den inaktiva X-kromosomen. När immuncellerna aktiverades, eller redo att svara på infektion, Xist-RNA återkom på rätt plats.
"Vi såg att de inaktiverade B-cellerna inte har detta RNA-moln, men det kommer tillbaka vid stimulering, ", sa Syrett. "Vi var verkligen intresserade av att avgöra vad som tar tillbaka Xist RNA."
Med hjälp av en fluorescerande spårmolekyl, teamet började med att spåra platsen för Xist i utvecklande B-celler i honmöss. De fann att prekursorerna till B-celler, såsom hematopoetiska stamceller och vanliga lymfoida stamceller, hade tydliga mönster av Xist-RNA på den inaktiva X-kromosomen. Men, när dessa B-cellsprekursorer gick en utvecklingsväg mot att bli B-celler, Xist RNA verkade först försvinna, dyker sedan upp igen, men bara som diffusa nålstick över kärnan istället för att vara lokaliserad till det inaktiva X.
Dessutom, små molekyltaggar som kallas heterokromatinmodifieringar, som är kända för att upprätthålla genrepression under X-krosominaktivering, försvann under utvecklingen av B-celler.
"Vi kunde se dessa riktigt ovanliga förändringar på kromatinnivån ske i kvinnlig B-cellsutveckling, sa Anguera.
För att ta reda på hur Xist återgick till det inaktiva X vid B-cellsaktivering, som de visade i förra årets PNAS-tidning, forskarna spårade Xist RNA i B-celler i kultur. De fann att återuppkomsten skedde i två distinkta faser:mellan fyra och 16 timmar efter att cellerna stimulerades, prickarna av Xist RNA började dyka upp. Och mellan 16 och 30 timmar efter stimulering, Xist-RNA koncentrerades uteslutande vid den inaktiva X-kromosomen. Heterokromatinmodifikationerna verkade öka och lokaliseras på det inaktiva X även i denna andra fas.
Teamets tidigare studie hade pekat på att proteinet YY1 spelar en roll i återkomsten av Xist i aktiverade B-celler, så de började titta närmare på det i detta arbete. Atchison, en ledare inom studier av YY1 i B-cellsutveckling, kunde låna ut sin expertis för att undersöka proteinets roll i X-kromosominaktivering.
När forskarna undersökte B-celler från möss som saknade YY1, de såg kraftigt reducerade nivåer av heterokromatinmärken samt mindre lokalisering av Xist-RNA till det inaktiva X.
Teamet observerade också bevis för att YY1 påverkade uttrycket av X-kromosomgener. När de raderade YY1 från manliga och kvinnliga celler och jämförde gener som uttrycktes differentiellt på X-kromosomen, de hittade 68 som var specifika för kvinnor, en som var specifik för män och 11 som delades.
Av de 68 generna som är specifika för kvinnor, många var relaterade till immunitet, och minst två är kända för att vara överuttryckta i humana kvinnliga B-celler jämfört med manliga B-celler.
En ytterligare uppsättning experiment identifierade området för YY1 med DNA-bindande aktivitet som nyckeldomänen för detta protein involverat i att föra Xist RNA till det inaktiva X.
"Det verkar fungera som en tjuder, föra samman Xist-RNA:t med DNA från den inaktiva X-kromosomen, sa Anguera.
Hon och hennes kollegor kommer att utforska rollen som YY1 ytterligare, använda kliniska prover såväl som musmodeller, att titta på proteinet i sjukdomar som lupus för att fördjupa sin förståelse för hur autoimmunitet kan bli resultatet av "flykt" av immungener från X-kromosominaktivering.
"Om du vill utveckla en terapi för autoimmuna sjukdomar, tanken är, Hur får vi Xist till den inaktiva X-kromosomen och håller den där så att vi bibehåller doskompensation i dessa B-celler?" sa Anguera. "Visst ser YY1 ut som ett riktigt lovande mål."