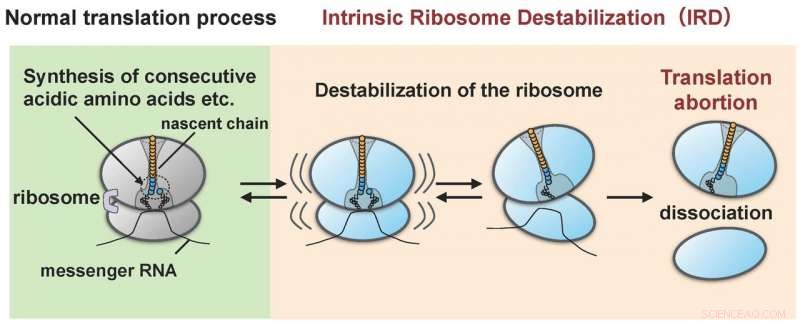
Ribosomen blir destabiliserad av proteinet (den begynnande kedjan) som det själv syntetiserat (IRD) och delas isär i de stora och små underenheterna. Som ett resultat, proteinsyntesen slutar mitt i cykeln utan att nå slutpunkten. Kredit:Hidekii Taguchi
En gemensam forskargrupp vid Tokyo Institute of Technology (Tokyo Tech) och Kyoto Sangyo University har upptäckt att ett protein, under dess syntes, kan destabilisera ribosomens struktur och avsluta sin egen syntes i förtid, och fann att detta fenomen används för att anpassa cellen till sin omgivning.
Bakgrund
Proteiner är funktionella molekyler, som stödjer liv och är tredimensionella strukturer av polypeptidkedjor, kedjor av länkade aminosyror. Konfigurationen av aminosyror på denna kedja (sekvensen) skrivs i DNA-sekvensen. Polypeptidkedjor bildas där ribosomen, proteinsyntesmaskineriet, finns på en kopia av DNA-sekvensen (budbärar-RNA). Den börjar polymerisera aminosyror en efter en genom att välja bland 20 typer av aminosyror för att lägga till länken enligt den genetiska koden. Den avslutas vid ändpunkten där kedjan lossnar från ribosomen.
Processen med att ett protein syntetiseras vid en ribosom kallas "översättning, "och alla proteiner från alla levande organismer, inklusive människor, produceras genom översättning. Man trodde att, i processen att länka aminosyror vid ribosomen, den nybildade polypeptidkedjan (begynnande kedja) syntetiserades kontinuerligt.
I nyare studier av denna forskargrupp och andra, det har blivit uppenbart att fluktuationer i hastighet inträffar betydligt vid översättning - att vissa växande kedjor, beroende på aminosyrasekvensen, agera på ribosomen som bildar den för att sakta ner translationsstegtiden.
Översikt över forskningsresultatet
Forskargruppen ledd av Hideki Taguchi vid Tokyo Tech och Koreaki Ito vid Kyoto Sangyo University fann att, när ett rekonstituerat cellfritt translateringssystem av E. coli gjordes för att translatera proteiner med sekvenser av cirka tio sura aminosyror (asparaginsyra och glutaminsyror) eller sekvenser där antingen sur aminosyra och en aminosyra som kallas prolin är länkade omväxlande, översättningen stannar halvvägs när en sådan sekvens har översatts. Denna misslyckade händelse inträffar när ribosomerna som syntetiserar aminosyrasekvensen blir destabiliserade som ett resultat av att de påverkas av den begynnande kedjan (forskarna betecknar denna "IRD":"intrinsic ribosom destabilization"). Det resulterar i att ribosomen splittras i de stora och små underenheterna (Figur 1). Ribosomen, med sin roll att syntetisera flera tusen eller tiotusentals typer av proteiner i cellen, hade ansetts vara ansvarig för att länka alla kombinationer av aminosyrasekvenser. Dock, upptäckten av IRD, där ribosomen destabiliseras under translation av begynnande kedjor som den själv syntetiserar, indikerar att översättning är något som fortskrider med potentiell risk att avbrytas. Proteiner som inkluderar aminosyrasekvenser som utlöser IRD kan inte slutföra sina synteser.
Vid första ögonkastet, detta fenomen med IRD kan verka som en defekt i ribosomen, men vad betyder det för levande organismer?
Forskarna hade upptäckt att levande organismer också har en mekanism för att motverka IRD. Detta fynd ledde till att de använde en mutant av E. coli som saknade denna mekanism, med ribosomer alltså något destabiliserade och benägna att IRD, och analysera allt protein inuti en cell (proteomen). Som ett resultat, laget fann att, i mutanten, de cellulära mängderna av ett antal proteiner varierade jämfört med den vilda stammen. Särskilt, MgtA, ett membranprotein som transporterar magnesiumjon in i celler, visade sig uttryckas över tio gånger mer. Intressant, genen som kallas mgtL och som reglerar uttrycket av MgtA hade en IRD-sekvens. Resultatet av analysen visade att E. coli reglerar uttrycket av MgtA, med hjälp av en speciell mekanism som presenterar IRD-fenomenet på grund av sekvensen av mgtL, som svar på förändringar i magnesiumkoncentrationerna i cellen.
Magnesiumjoner är nödvändiga för många livsprocesser inuti cellen, och krävs för översättning, särskilt, för att stabilisera ribosomen. Således, resultaten av denna forskning tyder på att E. coli förvärvat en mekanism för att upprätthålla den cellulära magnesiumjonkoncentrationen genom att använda mgtL:s IRD -förmåga att uttrycka ett överflöd av MgtA när dess tillväxtmiljö blir dålig i magnesium. Med andra ord, en levande organism har en mekanism för att övervaka förändringar i den intracellulära miljön genom att dra fördel av fenomenet IRD (Figur 2).
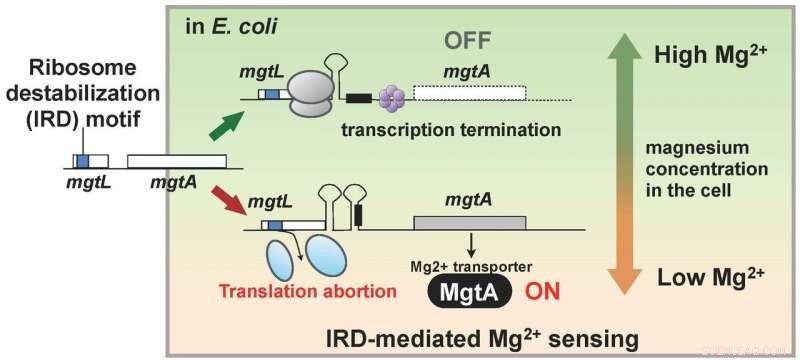
Genen, mgtL, kontrollera uttrycket av membranproteinet MgtA som transporterar magnesium in i celler har en ribosomdestabiliserande sekvens, och translation avbryts när magnesiumkoncentrationen inuti cellen är låg. Det finns en mekanism som sätter på MgtA-syntes när mgtL-translation avbryts, och man tror att det resulterande rikliga uttrycket av MgtA höjer magnesiumjonkoncentrationen inuti cellen. Kredit:Hideki Taguchi
Framtida utveckling
Denna studie visade att, förutom att innehålla information som bestämmer tredimensionella strukturer av proteiner, aminosyrasekvenser har till och med förmågan att påverka stabiliteten hos maskineriet som syntetiserar dem och att avbryta translation mitt i cykeln, så småningom. Detta främjar vår förståelse av grunden för livsprocesser, som stöds av reglerat uttryck av genetisk information. Tidigt, för tidigt upphörande av översättning hade hittills inte ansetts vara en vital process inom biovetenskapen. Taguchi och teammedlemmarna tror att deras prestation kan utökas, i samband med det nuvarande välståndet inom biovetenskap, till olika tillämpningar såsom produktion av nya användbara proteiner eller utveckling av biofarmaka.