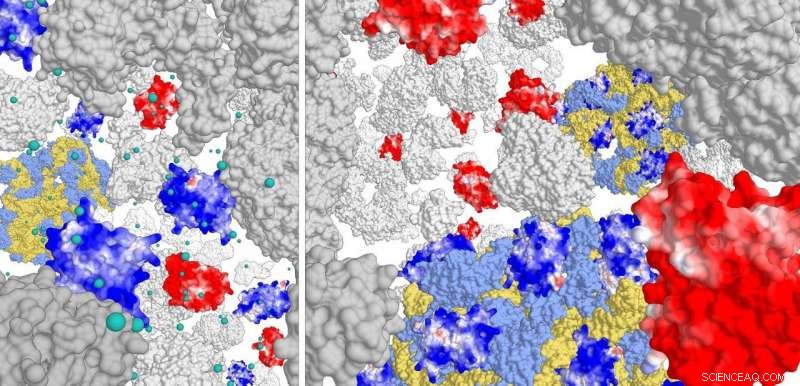
Höger panel:interaktion av positivt laddade proteiner (mörkblå) med ribosomkomplexet (ljusblått/gult). Negativt laddade proteiner interagerar inte. Vid hög jonstyrka (vänster panel) interagerar de positiva proteinerna knappast med ribosomen. Upphovsman:Poolman lab, University of Groningen
Cellerna är fyllda med makromolekyler, som begränsar spridningen av proteiner, särskilt i prokaryota celler utan aktiv transport i cytoplasman. När jag undersöker sambandet mellan trängsel, jonstyrka och proteindiffusion, Biokemister vid University of Groningen gjorde en fascinerande upptäckt:positivt laddade proteiner fastnar på ytan av ribosomkomplex. Detta förklarar varför de flesta vattenlösliga proteiner bär en övergripande negativ laddning. Upptäckten kommer snart att visas i tidningen eLife .
Proteinernas rörelsehastighet i cellerna är viktig:många processer i biologiska celler beror på interaktioner mellan makromolekyler (proteiner och nukleinsyror) och därmed deras förmåga att hitta varandra. 'Men cellcytoplasman är en livlig plats och detta kommer att påverka protein- och RNA -diffusion', anmärkningar University of Groningen Professor i biokemi Bert Poolman.
Kostnader
Hans grupp studerade effekterna av trängsel på diffusion, och fann ett samband mellan proteinstorlek och diffusionshastighet. 'Men för vissa proteiner hittade vi inte denna korrelation, så vi gav oss ut för att undersöka varför. ' Teamet använde tre olika prokaryoter med ökande jonstyrka:den gramnegativa bakterien Escherichia coli, den grampositiva Lactococcus lactis och extremofilen Haloferax volcanii, som lever vid mycket höga saltkoncentrationer.
För denna studie, forskarna konstruerade olika varianter av grönt fluorescerande protein (GFP), med ytladdningar från -30 till +25. De studerade sedan rörelsen för dessa GFP -varianter i de tre celltyperna. 'Vi såg att positivt laddade proteiner skulle diffundera mycket långsamt. De fastnade i cellen, förklarar Poolman. Ytterligare analys visade att de positiva proteinerna inte binder till DNA eller cellmembranet utan till ribosomkomplexet.
Intressant
En bioinformatikanalys av proteomerna hos mikroorganismer och eukaryota celler visade att i de flesta fall är ungefär 70 procent av proteinerna negativt laddade. 'Intressant, de återstående 30 procenten är antingen membranproteiner eller proteiner som är inblandade i funktionen eller vikningen av ribosomen eller mRNA. '
Membranproteinerna skyddas av chaperoner under biogenes, så de kommer inte att hålla fast vid ribosomerna. Det finns därför inga ”fria” cytoplasmatiska proteiner med tillräckligt hög laddning för att få dem att sätta sig på ribosomer. Den negativa laddningen av ribosomkomplexet och den omgivande jonstyrkan hos cytoplasman tycks ha format utvecklingen av laddningar i den cellulära proteomen.
Oväntat
Den nya och oväntade insikten om att proteinrörlighet är en funktion av proteinladdning kan förklara varför det är svårt att uttrycka vissa proteiner i bakteriesystem med låg jonstyrka. 'Vi observerade att en högre jonstyrka minskar klibbigheten hos positivt laddade proteiner. Det kan vara en värdefull insikt för byggandet av plattformar för uttrycksuttryck. '
En sista observation i eLife -papperet är att genomerna för flera endosymbionter visar ett överflöd av positivt laddade proteiner. "Detta fynd förvirrar oss verkligen", medger Poolman. 'Du skulle förvänta dig att alla dessa proteiner attraheras av endosymbionts ribosomer. Än så länge, vi har ingen förklaring till hur dessa organismer kan hantera långsam diffusion och ribosomer uppslukas av positiva proteiner. '