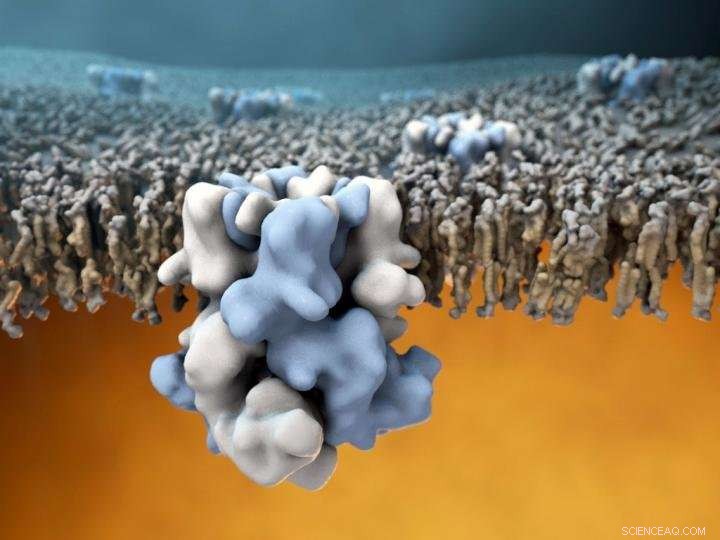
TRPM8-jonkanalen (blå och vit i mitten) är inbäddad i det yttre membranet av celler, och kan känna av kalla temperaturer på utsidan (den övre halvan av bilden), och kommunicera denna information till den varma cellulära interiören (nedre halvan av bilden). Kredit:Gabe Lander och Graham Johnson
Ett team av forskare från The Scripps Research Institute (TSRI) och Duke University har gjort den första bestämningen av atomstrukturen hos Transient Receptor Potential Melastatin 8 (TRPM8), en molekylär sensor i nervändar som upptäcker kalla temperaturer samt mentol och andra kemikalier som framkallar kalla förnimmelser.
Detta fynd bör öka forskarnas pågående ansträngningar att rikta in TRPM8 terapeutiskt. Läkemedelsföreningar som interagerar med kylsensorn – som mentolhaltiga salvor redan gör – kan kunna behandla vissa former av kronisk smärta och inflammation, migrän och till och med cancer.
"Att känna till atomstrukturen hos TRPM8 och hur den reagerar på kyla, mentol och andra stimuli bör hjälpa till vid utformningen av potenta och selektiva nya läkemedel som riktar sig till denna sensor, " sa studieledare Gabriel C. Lander, Ph.D., docent vid TSRI, som ledde studien tillsammans med Dr. Seok-Yong Lee vid Duke University School of Medicine.
Upptäckten, publicerad den 7 december, 2017 i tidningen Vetenskap , är också en betydande teknisk bedrift. Ända sedan det köldkännande proteinet först identifierades 2002, team runt om i världen har försökt men misslyckats med att fastställa TRPM8:s atomstruktur med hjälp av röntgenkristallografi, traditionellt sett den bästa metoden för att lösa strukturer med stora proteiner. Att erhålla en högupplöst struktur av TRPM8 har utgjort en stor utmaning för strukturbiologer delvis på grund av kanalens instabilitet när den är isolerad från sin naturliga miljö i cellmembranet. Utan membranstöd, TRPM8 har en tendens att förlora sin strukturella integritet, vilket gör målet mycket svårt att studera. TRPM8-sensorstrukturen är också relativt komplex, består av fyra identiska kopior av proteinet som kodas av TRPM8-genen.
För detta projekt, Lander och medförfattare Mengyu Wu, en doktorand i sitt laboratorium, valde istället att använda kryo-elektronmikroskopi (cryo-EM), en strukturbestämningsmetod som i allt högre grad föredras för svåra strukturstudier. Lee och hans team började med att screena TRPM8-proteiner från mer än ett dussin olika djurarter, inklusive människor, möss, och fåglar, för att hitta en som sannolikt var "bäst uppförd" för en cryo-EM-studie. De slog sig ner på TRPM8-proteinet från en fågel som kallas halsbandsflugsnapparen.
"Alla bevis pekar på att flugsnapparen TRPM8 fungerar på samma sätt som TRPM8 från däggdjur, så vi är övertygade om att vår strukturella analys kommer att översättas direkt till den mänskliga formen av denna sensor, " sa Lander.
Forskarna mötte många hinder på grund av den inneboende instabiliteten hos TRPM8 utanför dess inhemska membranmiljö. "Även inom en enda dag efter att proverna skickades från Duke till TSRI, proteinkomplexet skulle börja falla isär, " sa Wu. "Lea-labbet lade strategiskt till några stabiliserande mutationer till proteinet så att det skulle vara mindre benäget att nedbrytas." Ying Yin, en doktorand i Lee-laboratoriet, gick också tillbaka och genomsökte noggrant flera reningsförhållanden för att ge provet ytterligare stabilitet.
Proteinet betedde sig också annorlunda än de flesta av de prover som Lander-labbet vanligtvis arbetar med för elektronmikroskopi, och det tog forskarna över ett år att identifiera de rätta förutsättningarna för att avbilda denna utmanande biomolekyl.
"Vi var tvungna att kasta ut regelboken och ompröva det vanliga sättet att lösa den här typen av struktur, sa Lander.
Genom dessa anpassningar, forskarna kunde få den första strukturella glimten av TRPM8 med en total upplösning på cirka 4 Ångström (0,4 miljarddels meter). Den resulterande atommodellen innehöll också några överraskningar. "Andra grupper har antagit hypoteser om strukturen hos TRPM8 och hur den interagerar med bindningspartners som mentol, men vad vi fann var att praktiskt taget alla dessa välutbildade gissningar var ganska långt borta, " sa Lander. I synnerhet, bindningsfickan för mentol visade sig vara på en oväntad plats, skiljer sig från ligandbindningsplatsen i andra TRP-sensorer.
"En sak som den här strukturen säger oss är att TRP-sensorer inte alla fungerar på samma sätt, och så jag förväntar mig att vi kommer att upptäcka många nya sensormekanismer när vi studerar fler av dessa TRP-strukturer, " sa Lander.
TRPM8 är av intresse för läkemedelsindustrin delvis på grund av smärtstillande, antiinflammatoriska effekter den kan ha när den aktiveras. Dessutom, varianter av dess gen har kopplats till en benägenhet för migrän, och forskare har visat att manipulering av TRPM8 kan orsaka migränliknande smärta hos djur.
"TRPM8 uttrycks också onormalt i vissa prostata, bröstcancer och andra cancerformer, gör det till ett potentiellt kemoterapeutiskt mål, " sa Wu.
Även om TRPM8 är mest känd som en perifer nervsensor för måttligt kalla temperaturer (under cirka 25°C) och för kallsensationsmolekyler som mentol, det finns också i många andra normala vävnader, även djupt inne i kroppen, och dess funktioner i dessa vävnader förblir i stort sett oklara. En detaljerad förståelse av TRPM8:s strukturella interaktion med dess naturliga bindningspartner bör leda till utvecklingen av bättre molekylära sonder som kan hjälpa forskare att avslöja dess olika funktioner.
Lander och Lee Laboratories arbetar nu för att bättre förstå hur TRPM8 interagerar med mentol och andra terapeutiska bindningspartners molekyler.