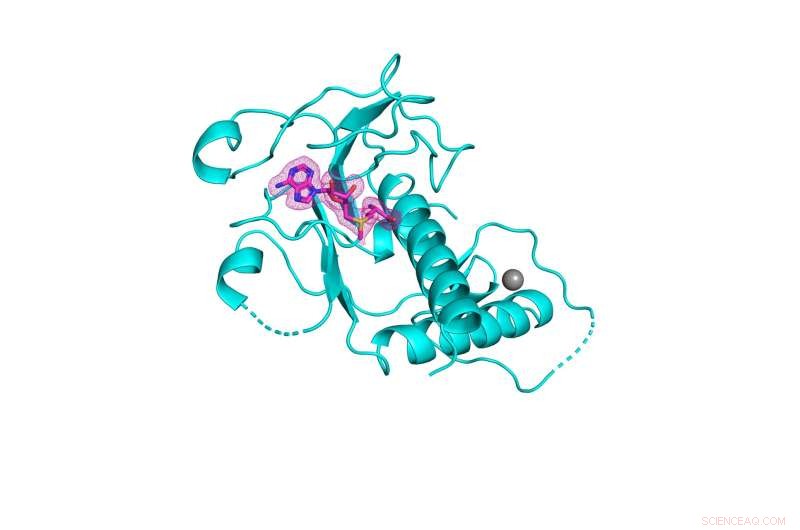
3D-struktur av SARS-CoV-2 nsp14 metyltransferasdomän (visad i cyan) bunden till dess naturliga kofaktor S-adenosylmetionin (visas i rosa nät). Kredit:Kottur, et al; Naturens strukturella och molekylära biologi
Ett team av Mount Sinai-forskare har tagit fram en högupplöst kristallstruktur av ett enzym som är nödvändigt för överlevnaden av SARS-CoV-2, viruset som orsakar COVID-19. Upptäckten kan leda till utformningen av kritiskt nödvändiga nya antivirala medel för att bekämpa nuvarande och framtida coronavirus.
Enzymet, känt som nsp14, har en mycket viktig region känd som RNA-metyltransferasdomänen, som har undgått tidigare försök från forskarvärlden att karakterisera dess tredimensionella kristallstruktur. En artikel som beskriver den innovativa processen publicerades i onlineupplagan den 8 september av Nature Structural &Molecular Biology .
"Att kunna visualisera formen på metyltransferasdomänen av nsp14 i hög upplösning ger oss insikter i hur man designar små molekyler som passar in i dess aktiva plats, och därmed hämmar dess väsentliga kemi", säger senior författare Aneel Aggarwal, Ph.D. , professor i farmakologiska vetenskaper vid Icahn School of Medicine vid berget Sinai. "Med denna strukturella information, och i samarbete med läkemedelskemister och virologer, kan vi nu designa små molekylhämmare för att lägga till familjen av antivirala medel som går hand i hand med vacciner för att bekämpa SARS-CoV-2."
Receptbelagda antivirala medel som är inriktade på nyckelenzymer av SARS-CoV-2 inkluderar nirmatrelvir för huvudproteaset (M Pro ) enzym och molnupiravir och remdesivir för enzymet RNA-polymeras (nsp12). Forskningen för att utveckla nya antivirala medel som riktar sig till olika enzymatiska aktiviteter har accelererat i laboratorier runt om i världen, och berget Sinais upptäckt har bidragit avsevärt till denna ansträngning.
"En del av det som driver vårt arbete", säger Dr. Aggarwal, "är kunskapen från att behandla HIV – att du vanligtvis behöver en cocktail av inhibitorer för maximal effekt mot viruset."
Mount Sinai-teamet utvecklade faktiskt tre kristallstrukturer av nsp14, var och en med olika kofaktorer, från vilka de identifierade den bästa ställningen för design av antivirala medel för att hämma RNA-metyltransferasaktiviteten som enzymet möjliggör och viruset behöver för att överleva. Enligt deras schema skulle det antivirala medlet ersätta den naturliga kofaktorn S-adenosylmetionin, vilket förhindrar att metyltransferas-kemin uppstår. Kristallstrukturerna som teamet har belyst har gjorts tillgängliga för allmänheten och kommer nu att fungera som guider för biokemister och virologer globalt för att konstruera dessa föreningar.
Att göra upptäckten möjlig var förmågan hos forskare att rensa ett hinder som hade hindrat andra från att skapa tredimensionella kristaller av nsp14-metytransferasdomänen. "Vi använde en metod som kallas fusionsassisterad kristallisering", förklarar huvudförfattaren Jithesh Kottur, Ph.D., en postdoktor vid Icahn Mount Sinai och en kristallograf och biokemist. "Det handlar om att smälta samman enzymet med ett annat litet protein som hjälper det att kristallisera."
Dr. Aggarwal, en internationellt erkänd strukturbiolog, understryker vikten av pågående utredningsarbete av forskare inom sitt område mot ett virus som har lett till miljontals dödsfall globalt. "Viruset utvecklas så snabbt att det kan utveckla resistens mot de antivirala ämnen som nu finns tillgängliga, varför vi måste fortsätta att utveckla nya", konstaterar han. "På grund av den höga sekvenskonserveringen av nsp14 över coronavirus och deras varianter (vilket betyder att den inte muterar mycket), kommer vår studie att hjälpa till med utformningen av bredspektrumantivirala medel för både nuvarande och framtida coronavirusutbrott." + Utforska vidare