Kredit:Wikipedia
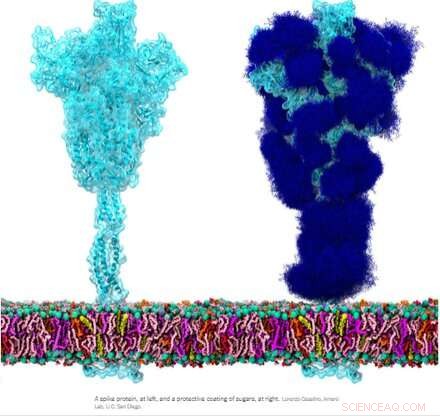
Det homotrimera spikglykoproteinet (S) från SARS-CoV-2, särskilt dess S2-subenhet, är ett extraordinärt fusionsprotein. Det kan smälta virala partiklar till celler och även smälta celler till celler för att skapa mångfaldiga syncytier bland olika cellfenotyper. Beroende på vilka exakta versioner som övervägs, kan spiken utföra dessa bedrifter via flera mekanismer som verkar på både de intracellulära och extracellulära sidorna av cellmembranen.
Dessa fusionsfunktioner är något analoga med typiska homotrimera ENV-proteiner (hölje) som vårt syncytin-1 endogena retrovirala ENV-protein och GP160 ENV-glykoproteinet från HIV-viruset. GP160, HIV-spetsproteinet, bearbetas slutligen vid sitt eget furinklyvningsställe (finns också i syncytin-1) till ett GP120- och ett GP41-protein, som båda kan anta distinkta pre- och postfusionskonfigurationer. SARS-CoV-2-genomet specificerar emellertid redan ett separat litet ENV-protein (bekvämt betecknat som E), som sätts samman till en presumtiv katjonkanal med en central fusionspor.
Det finns inga env-, pol-, gag- eller pro-gener definierade som sådana för SARS-CoV-2-genomet, vilket är fallet för retrovirusen, som måste integreras i vårt DNA som en del av deras livscykel. Märkligt nog har forskare funnit att spikproteinet SARS-CoV-2, som beter sig av sig självt, direkt deltar i aktiveringen av endogena retrovirus i våra celler, vilket bidrar till observerad patologi. Vad är det egentligen som händer här?
I ljuset av några av dessa likheter har det föreslagits att antikroppar som genereras mot spikproteinet potentiellt kan korsreagera i alla vävnader som kan uttrycka endogena retrovirala proteiner. I synnerhet under graviditet, varpå placenta trofoblaster uttrycker mycket användbara ENV-proteiner från många sådana HERV inklusive ERVW1 (syncytin-1), ERVFRD-1 (syncytin-2), ERVV-1, ERVV-2, ERVH48-1, ERVMER34-1 ERV3-1 och ERVK13-1. Syncytin-2-uttryck i villösa cytotrofoblaster är emellertid starkt korrelerat med svårighetsgraden av någon patologi i placenta som havandeskapsförgiftning.
Lyckligtvis fann forskare att det praktiskt taget inte finns någon direkt sekvenshomologi mellan spike och syncytin-1, och liten chans för korsreaktivitet. Skriver i tidskriften Animal Cells and Systems , testade koreanska forskare en stor panel av monoklonala antikroppar och kunde dra slutsatsen att även om forntida genomiska reliker som HERV kan aktiveras i olika vävnader av SARS-CoV-2, finns det ingen risk för korsreaktivitet eller ens infertilitet.
Men om spikprotein fortfarande är mycket kapabel att orsaka oönskad cellfusion, hur kan vi bättre definiera denna till synes slumpmässiga aktivitet, och dessutom, vad kan vi göra åt det? Det första steget är kanske att bli lite mer sofistikerad med terminologin för cellfusion. Skriver i tidskriften Oncotarget , ger författaren Yuri Lazebnik lite att tänka på. Ett syncytium producerat från celler av samma typ, till exempel, som vid sammansmältning av två eller flera pneumocyter, kallas en homokaryon. Ett heterokaryon skulle då vara ett syncytium tillverkat av t.ex. en pneumocyt sammansmält med en epitelial stamfader, eller kanske en leukocyt. I allmänhet är alla satsningar avstängda när celler väl kombinerats – huruvida de senare kan sortera sig själva och sina kärnor för att generera replikationskompetenta mononukleära avkommor är fortfarande ofullständigt känt.
Formation of spike-induced syncytia in the lungs of COVID-10 patients has been found in many forms, each with their own emergent properties that can contribute to disease sequelae. For example, ciliated cells in the airway, alveolar type 2 pneumocytes, and epithelial progenitors have all been found to participate in the oft-observed multinucleated 'giant cells.' Throw in a spike-laden leukocyte or two and things rapidly get hard to predict. Perhaps an even more alarming situation would be formation of a syncytium in the cells lining our blood vessels that could contribute to thrombosis. The ensuing death and eventual sloughing off of a patch of inappropriately fused cells could expose a sizeable region of thrombogenic basement membrane. A 20-micron fiber of collagen, the main component of the basement membrane, is sufficient to trigger platelet-dependent clotting.
But enough of this fear-mongering. Researchers have identified a set of already approved drugs that prevent spike-induced cell fusion and inhibit TMEM16F, a critical protein for syncytium formation. TMEM16F has the dual role of being a calcium-activated ion channel that regulates chloride secretion, as well as a lipid scramblase that relocates phosphatidylserine (PS) to the cell surface. This PS externalization is required for cell fusion in many systems, including spike-induced syncytia. Incidentally, scramblases also control the rate-limiting steps of the blood coagulation cascade, and may be the mechanism behind spike-induced thrombosis.
The blood coagulation pathways are a whole separate complex can of worms, but suffice it to say here that the primary trigger of coagulation induced by viral infections is the so-called extrinsic 'tenase.' Tenases are enzymes that process Factor X, or FX, (hence ten-ase), in the Tissue Factor (TF) activation pathway, which essentially act as the fuse for thrombus generation. The resulting complexes are assembled on externalized PS in the presence of calcium ions. TF is, in a sense, encrypted and so is unable to activate its downstream target factor FVIIa until it is de-encrypted by externalized PS.
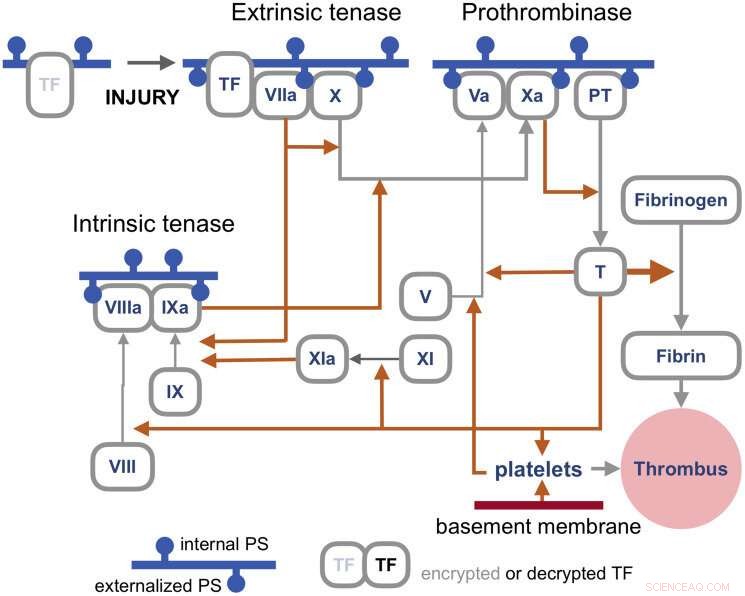
Coagulation pathways. Credit:Y. Lazebnik 2021
The realization that some fusogenic viral, or even retroviral proteins, which are fortuitously expressed in particular regions of the body may likely contribute to thrombotic events is of tremendous practical importance. One need look no further than Moderna's ample proposed pipeline for therapeutic mRNA-delivered amenities based on these proteins for all manner of viral insults to have some pause for inspection. There is certainly no shortage of methods currently employed for building antigenic spike proteins for vaccinations. Depending of how much of the spike code is used, which cleavage sequences are included, and which parts are stabilized, very different proteins can be made. It is probably fair to say that full-length spikes in large questionable vectors or inactivated viral particles have been largely de-emphasized in favor of smaller but more immunogenic concoctions.
Lungs and blood vessels are certainly critical areas of concern in any SARS-CoV-2 infection, but what our precious neurons—can spike fuse them as well? Clearly it can fuse neurons in brain organoids, but then again, what can't researchers do with these instant research publication miracles. In looking more braodly at other kinds of viruses, the fusion of neurons, glial cells, and even axons seems to be par for the course in causing a myriad constellation of potential neurological issues. For example, the pseudorabies virus bridges synapses to electrically couple the activity of neurons by fusing their axons. Fusions with glia have similarly been detected and linked with lasting neuropathic pain after the acute phase of herpes zoster (shingles). As of this Wednesday, we all are further aware that SARS-CoV-2 can utilize the protein vimentin as a way to infect endothelial cells. It should escape no one's notice, or at least that of the neuroscientists, that vimentin is the prime marker used for identifying glial cells.
Additionally, the rapidly expanding body of work looking at endogenous retrovirus re-activation in neurodegenerative disease further suggests to the rational mind that cell fusion may also be involved in this kind of pathology.