Vissa proteiner ändrar sin form när de utsätts för olika temperaturer, vilket avslöjar tidigare okända bindningsställen för mediciner, har ny forskning funnit.
Fynden, publicerade i Nature , skulle kunna revolutionera stora delar av biologin genom att i grunden förändra hur proteinstruktur studeras och utnyttjas för läkemedelsdesign. Studien leddes av Van Andel Institutes Juan Du, Ph.D., och Wei Lü, Ph.D.
Proteiner undersöks i allmänhet vid låga temperaturer för att säkerställa deras stabilitet. Den nya studien visar dock att vissa proteiner är mycket känsliga för temperatur och ändrar form när de ses vid kroppstemperatur.
"Under lång tid kräver de metoder vi har använt för att studera proteiner att de är kalla eller frysta. Men i den verkliga världen existerar mänskliga proteiner och fungerar vid kroppstemperatur," sa Du. "Vår studie beskriver ett nytt sätt att studera proteiner vid kroppstemperatur och avslöjar att vissa proteiner drastiskt förändrar sina strukturer när de är varma, vilket öppnar nya möjligheter för strukturstyrd läkemedelsutveckling."
Proteiner är kroppens molekylära arbetshästar. Deras form styr hur de interagerar med andra molekyler för att göra sitt jobb. Genom att bestämma proteinstrukturen kan forskare skapa ritningar som styr utvecklingen av mer effektiva mediciner, ungefär som låssmeder som designar nycklar för att passa in i specifika lås.
Även om det är välkänt att temperatur påverkar molekylär funktion i kroppen, har det varit tekniskt utmanande att studera proteiner vid fysiologisk temperatur. Studien från Du och Lü-laboratorierna beskriver hur de övervann dessa problem och ger forskarna en färdplan för att göra det i sina egna experiment.
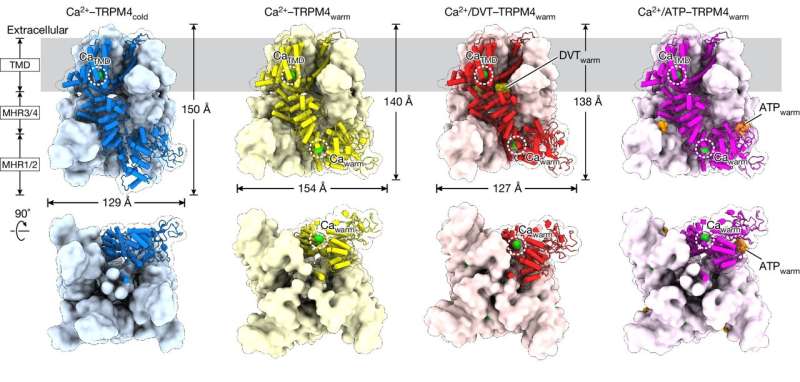
Studien fokuserade på ett protein som heter TRPM4, som stöder hjärtfunktion och metabolism, inklusive frisättning av insulin. Som sådan är TRPM4 kopplat till stroke, hjärtsjukdomar och diabetes, bland andra hälsotillstånd.
För att visualisera TRPM4 vid kroppstemperatur utnyttjade teamet VAI:s kraftfulla svit av kryoelektronmikroskop (cryo-EM), som gör det möjligt för forskare att flashfrysa proteiner och sätta ihop detaljerade bilder av deras strukturer. Istället för att använda ett lågtemperaturprov, värmde postdoktor Jinhong Hu, Ph.D., och kollegor i Du och Lü laboratorierna provet till kroppstemperatur innan det frystes ned. Genom att göra det fann de att ligander – molekyler som binder till proteiner – interagerar med helt andra platser på TRPM4 vid kroppstemperatur än vid lägre temperaturer.
Implikationerna av dagens studie är långtgående och förstärker vikten av att studera proteiner vid kroppstemperatur för att säkerställa identifiering av fysiologiskt relevanta läkemedelsbindningsställen.
Andra författare inkluderar Sung Jin Park, Ph.D., Tyler Walter, Ph.D., Ian J. Orozco, Ph.D., Garrett O'Dea och Xinyu Ye från VAI. Cryo-EM-data samlades in vid VAI:s Cryo-EM Core och David Van Andel Cryo-Electron Microscopy Suite.
Mer information: Jinhong Hu et al, Fysiologisk temperatur driver TRPM4-ligandigenkänning och gating, Nature (2024). DOI:10.1038/s41586-024-07436-7
Journalinformation: Natur
Tillhandahålls av Van Andel Research Institute