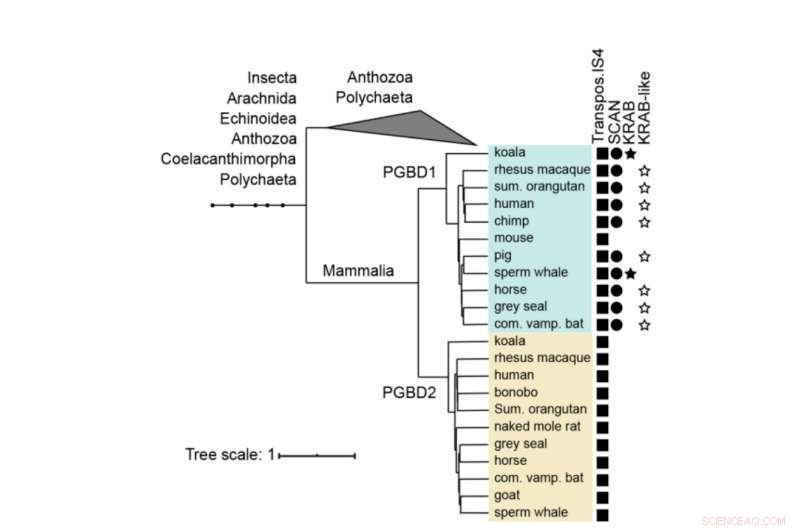
Fylogenetiska träd av PGBD1 och PGBD2. Närvaron av de transposas-härledda domänerna SCAN och KRAB visas. De mänskliga PGBD1 och PGBD2, med de närmast besläktade sekvenserna (innehållande transposas IS4) justerades med muskler och ett träd byggdes med MrBayes. Proteindomäner kommenterades med hmmerscan och CDD (NCBI). KRAB-domänen kommenterades med Phyre2. Kredit:Molecular Biology and Evolution (2022). DOI:10.1093/molbev/msac175
Evolution framställs ofta som en "pysslande" process, en som använder sig av små modifieringar av redan existerande möjligheter. Så hur utvecklar organismer helt nya strukturer?
En ny studie av Dr Zsuzsanna Izsvák från Max Delbrück Center for Molecular Medicine i Helmholtz Association (Max Delbrück Center) och professor Laurence Hurst från Milner Center for Evolution vid University of Bath (UK) fann bevis för att utvecklingen av en ny gen underbygger utvecklingen av en ny struktur som finns i nervceller. De beskriver denna ovanliga gen som kallas piggyBac Transposable Element-derived 1, eller PGBD1, i tidskriften Molecular Biology and Evolution .
'Hoppande gener' orsakar mutationer
PGBD1 är en av fem relaterade PGBD-gener som visar en distinkt likhet med piggyBac-elementet som först identifierades i insekter - därav namnet piggyBac Transposable Element-derived. PiggyBac-elementen är "hoppande gener", även kallade transposoner. De kan kopiera sig själva och flytta från en plats i genomet till en annan, ibland införa mutationer eller ändra funktioner. PiggyBac-transposoner anlände till vår art genom horisontell överföring - liknande hur vissa virus kan integrera sitt genom i vårt DNA.
Men medan piggyBac-transposonerna har förlorat sin förmåga att hoppa runt i vårt DNA med tiden, har fem piggyBac Transposable Element-derived gener (PGBD1-5) fixerats i människor. "Vi syftade till att ta reda på vilken potentiellt användbar funktion PGBD-generna kan ha", säger Zsuzsanna Izsvák. "För den här studien fokuserade vi på PGBD1."
Bland de fem PGBD-generna är PGBD1 unik genom att den även har inkorporerat delar av andra gener, vilket resulterar i ett protein som har extra delar som kan binda andra proteiner och binda DNA. PGBD1 är alltså en ny gen som delvis är ett mänskligt genfragment, delvis en inaktiv hoppgen.
PGBD1 reglerar nervceller och deras "proteinfällor"
PGBD1 finns endast i däggdjur. Det är särskilt aktivt i celler som blir neuroner. Forskarna undersökte först var PGBD1-protein binder till DNA, och observerade att det limmar sig i och runt gener som är associerade med nervutveckling. De fann att PGBD1 kontrollerar utvecklingen av nervceller genom att blockera gener som uttrycks i mogna nervceller samtidigt som de gener som är associerade med att vara pre-nervceller aktiveras. Att minska nivån av PGBD1 i pre-nervceller fick dem att börja utvecklas som nervceller.
En av generna som PGBD1-protein binder tilldrog sig särskilt deras intresse. NEAT1 är en konstig gen som kodar för ett RNA som, ovanligt, inte sedan fortsätter att göra ett protein. Istället utgör denna produkt, ett icke-kodande RNA, ryggraden i en fysisk struktur, paraspäckarna. Dessa är små strukturer i kärnorna i några av våra celler som fungerar som fällor för vissa RNA och proteiner.
Forskarna fann att i pre-nerveceller binder PGBD1-protein till NEAT1-genen och hindrar den från att fungera. Men när PGBD1-nivåerna sjunker, går NEAT1-RNA-nivåerna upp, paraspäckar bildas och cellerna blir mogna nervceller. PGBD1 har således utvecklats till att vara en nyckelregulator för närvaro eller frånvaro av paraprickar, och därmed regulatorn av nervcellsutveckling.
Evolution är inte slumpmässigt mixtrande
Det som dock är mest spännande är att paraspäckar, liksom PGBD1, också är däggdjursspecifika. PGBD1 är då ett sällsynt exempel på en ny gen som har utvecklats för att reglera en ny struktur, om än en ganska liten sådan. Zsuzsanna Izsvák, co-senior författare från Max Delbrück Center, säger:"Detta är en riktigt ovanlig och otrolig upptäckt. Vi har vetat att duplicering av redan existerande gener kan underbygga utvecklingen av nyhet, men detta är ett sällsynt exempel på hur evolution gör mer än bara att mixtra. Det här är en ny gen för att kontrollera en ny struktur." Den spännande frågan nu är om det också spelar någon roll i vuxna neuroner.
Co-senior författare professor Laurence Hurst från Milner Center for Evolution vid University of Bath tillägger att de "har räknat ut hur paraspeckle kontrolleras, nu behöver vi bara ta reda på hur paraspeckle själv utvecklats. Detta kan vara en mycket svårare uppgift eftersom icke-kodande RNA som NEAT1 tenderar att utvecklas snabbt och därför är svåra att spåra under evolutionär tid."
Denna koppling mellan NEAT1 och PGBD1 kan också vara involverad i schizofreni. Medan NEAT1 tidigare har associerats med denna neurologiska sjukdom, identifierade teamet några mutationer i PGBD1 som de kunde visa var också vanliga hos patienter med schizofreni - en av dessa mutationer förändrar proteinet i PGBD1 medan andra kan kontrollera dess nivå.
Förste författare Dr Tamas Raskó, vid tidpunkten för studien en postdoktor i gruppen av Zsuzsanna Izsvák säger att "det är säkert mer än en slump att båda generna är involverade i schizofreni. Det är mycket ovanligt att hitta en mutation som förändrar en protein som är kopplat till denna sjukdom. Effekterna av denna mutation måste vara en prioritet för vidare studier." + Utforska vidare