Pyroptos är en typ av programmerad celldöd som förmedlas av proteinfamiljen gasdermin (GSDM), som spelar viktiga roller i kroppens försvar mot patogeninfektion, eliminering av onormala eller skadliga celler och andra processer. GSDM:er är en evolutionärt konserverad klass av porbildande proteiner som är brett spridda bland olika bakterier, svampar, ryggradslösa djur och alla ryggradsdjur.
GSDM:er har vanligtvis en autoinhiberad tvådomänstruktur. Proteolytisk klyvning verkar vara en universell mekanism för aktivering av alla GSDM. Huruvida det finns andra aktiveringsmekanismer än proteasklyvning för GSDM är okänt.
I en studie publicerad i Science , har forskare under ledning av Prof. Ding Jingjin från Institute of Biophysics vid den kinesiska vetenskapsakademin och Prof. Shao Feng från National Institute of Biological Sciences avslöjat nya mekanismer för klyvningsoberoende aktivering av två typer av GSDM-proteiner från lägre eukaryoter.
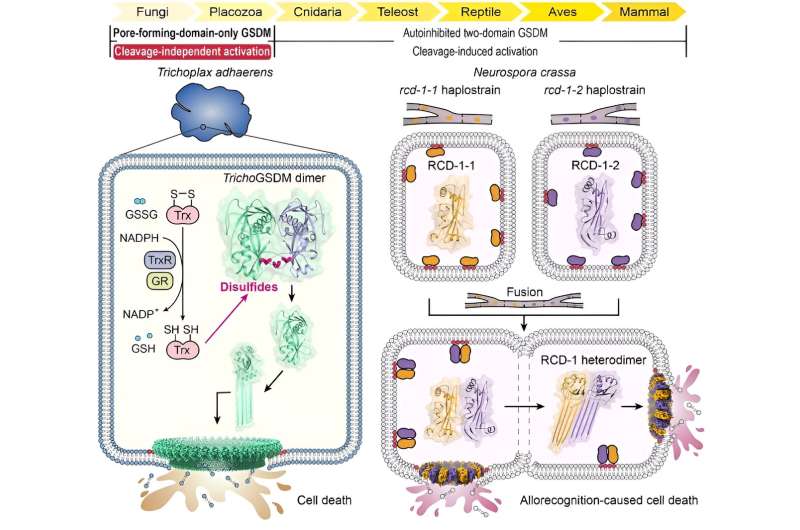
Genom omfattande sekvenshomologianalys identifierade forskarna först ett GSDM-protein i den basala metazoanen Trichoplax adhaerens (TrichoGSDM) som endast innehåller en porbildande domän. Karakterisering av renat TrichoGSDM avslöjade att detta GSDM-protein existerar i två tillstånd:monomer och homodimer, med endast det monomera proteinet som har förmågan att bilda porer på liposomer.
Strukturella och biokemiska analyser avslöjade att den disulfidbundna homodimeren representerar det autoinhiberande tillståndet av TrichoGSDM, som aktiveras till det monomera tillståndet genom att reducera disulfidbindningar, ytterligare oligomerisera och bilda porer på cellmembranet för att inducera pyroptos-liknande celldöd. Denna nya aktiveringsmekanism, upptäckt i TrichoGSDM, är den första i sitt slag i hela GSDM-familjen.
Dessutom fokuserade forskarna på en annan typ av porbildande domän-endast GSDM-protein som kallas RCD-1, som nyligen identifierades i den trådformade svampen Neurospora crassa. RCD-1 innehåller två homologa proteiner, RCD-1-1 och RCD-1-2 i olika stammar, som styr allorekognitionsinducerad svampcelldöd.
De fann att membranbundna RCD-1-proteiner existerar i ett inaktivt vilotillstånd när de lämnas ensamma. Men när olika stammar genomgår cellfusion, möter de två RCD-1-proteinerna varandra och sätts samman till en heterodimer genom specifik intermolekylär igenkänning, vilket ytterligare bildar heterooligomera porer på cellmembranet för att utföra pyroptos-liknande celldöd.
I den här studien representerar TrichoGSDM och RCD-1 två typer av porbildande GSDM:er endast för domäner härledda från enkla och gamla eukaryoter som använder distinkta klyvningsoberoende aktiveringsmekanismer.
TrichoGSDM är en disulfidkopplad autoinhiberad dimer och aktiveras genom reduktionen av disulfiderna, vilket tyder på en redox-responsiv funktion. Den porbildande aktiviteten i RCD-1 stimuleras av heteroigenkänning mellan RCD-1-1 och RCD-1-2 från genetiskt ojämförbara svampstammar, som ligger bakom allorekognitionsinducerad celldöd i N. crassa.
De olika aktiveringsmekanismerna tyder på att GSDM-proteiner kan svara på ett brett spektrum av fysiologiska signaler och delta i flera biologiska processer. Dessutom har dessa porbildande GSDM-proteiner med endast domän potential att utvecklas som nya verktyg för att inducera celldöd oberoende av proteasklyvning, vilket underlättar pyroptosrelaterad grundforskning och translationell forskning.
Mer information: Yueyue Li et al, Klyvningsoberoende aktivering av gamla eukaryota gasderminer och strukturella mekanismer, Science (2024). DOI:10.1126/science.adm9190
Journalinformation: Vetenskap
Tillhandahålls av Chinese Academy of Sciences