RNA-interferens (RNAi) är en fascinerande biologisk process i maskar, växter, svampar och metazoer som har varit ett värdefullt verktyg för att studera genfunktion och som terapeutik.
I Caenorhabditis elegans spelar multipass-transmembranproteinet, systemiskt RNA-interferensdefekt protein 1 (SID-1), en oumbärlig roll i upptaget och leveransen av dubbelsträngat RNA (dsRNA) mellan celler och vävnader, vilket leder till systemiskt RNAi.
Dessutom har två humana SID-1-homologer, SID1 transmembranfamiljemedlem 1 (SIDT1) och SIDT2, varit inblandade i RNA-transport. De underliggande molekylära mekanismerna för hur SID-1 specifikt skiljer dsRNA från enkelsträngat RNA (ssRNA) och DNA och underlättar efterföljande dsRNA-transport mellan celler förblir dock okända.
Svar på dessa frågor är viktiga för att förstå systemiskt RNAi och för att hjälpa till med RNA-relaterade tillämpningar.
Dr Zhang Jiangtao i Prof. Jiang Daohuas grupp från Institute of Physics vid den kinesiska vetenskapsakademin, har visat hur SID-1 specifikt känner igen dsRNA och gett viktiga insikter i internaliseringen av dsRNA av SID-1 genom att kombinera cryo-EM, in vitro och in vivo experiment. Arbetet publiceras i tidskriften Nature Structural &Molecular Biology .
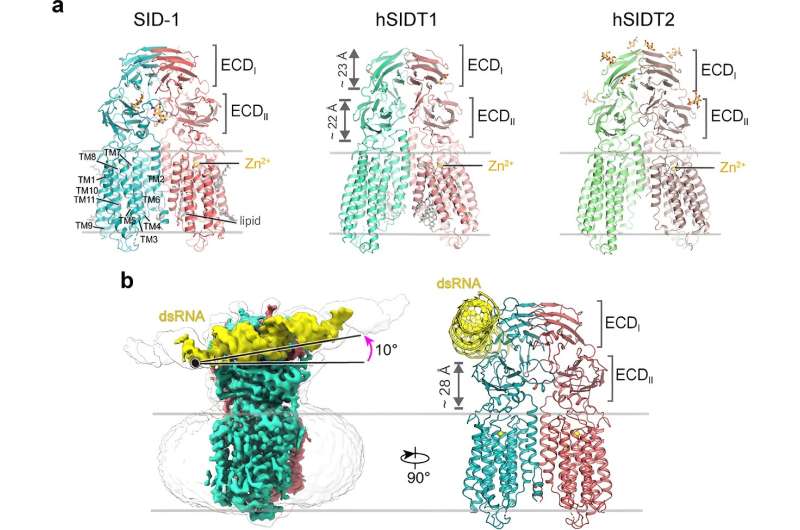
I mer än två decennier ansågs SID-1 fungera som en dsRNA-kanal. Här löste forskarna högupplösta cryo-EM-strukturer av SID-1 och de humana SID-1-homologerna SIDT1 och SIDT2, vilket avslöjade den konserverade arkitekturen hos C. elegans och humana SID-1-homologer.
SID-1-homologerna är organiserade på ett homodimert sätt. Överraskande nog visar SID-1-dimeren inte en uppenbar por inom transmembrandomänen, vilket tyder på att SID-1 kanske inte fungerar som en dsRNA-kanal. MST-bindningsanalyser bekräftade att SID-1 effektivt och specifikt kan binda till dsRNA men inte till dsDNA.
Därefter erhöll forskarna kryo-EM-strukturen av SID-1-dsRNA-komplexet, vilket visar det detaljerade dsRNA-bindningssättet och de molekylära determinanterna för hur SID-1 skiljer dsRNA från ssRNA och DNA.
Intressant nog är sådana determinanter inte närvarande i human SIDT1 eller SIDT2. De strukturella fynden stöddes av mutagenesstudier med MST-bindningsanalyser, dsRNA-upptag i S2-celler och in vivo systemiska RNAi-analyser.
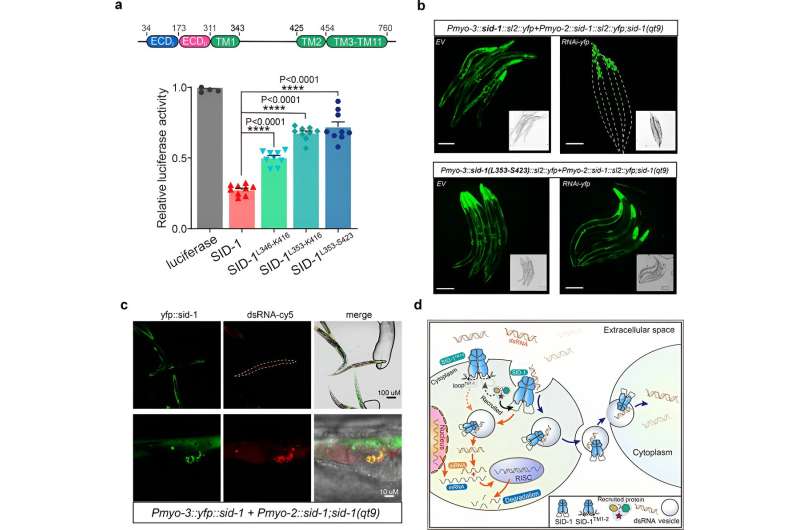
Slutligen visar forskarna att avlägsnandet av de långa intracellulära slingornas transmembranspiraler 1 och 2 inte påverkade SID-1-dimerisering, celllokalisering eller dsRNA-bindning, men det försämrade signifikant dsRNA-upptaget i S2-celler och systemiskt RNAi i C. elegans.
Dessutom avslöjade samlokalisering att SID-1 och dsRNA samlokaliseras i vesikelliknande subcellulära organeller. Baserat på dessa resultat föreslår forskarna att SID-1 fungerar som en dsRNA-receptor och underlättar efterföljande internalisering av dsRNA genom att rekrytera endocytrelaterade proteiner via den långa slingan.
Mer information: Jiangtao Zhang et al, Strukturella insikter i dubbelsträngat RNA-igenkänning och transport av SID-1, Nature Structural &Molecular Biology (2024). DOI:10.1038/s41594-024-01276-9
Journalinformation: Naturstruktur och molekylärbiologi
Tillhandahålls av Chinese Academy of Sciences