Forskare använder kraftfulla röntgenstrålar för att avslöja molekylära strukturer på platsen där läkemedelsföreningar interagerar med cellreceptorer. Dessa strukturer hjälper till att utforma framtidens läkemedel. Upphovsman:Greg Stewart/SLAC National Accelerator Laboratory
Forskare hoppas kunna utforma en ny generation läkemedel mot en rad dödliga sjukdomar. Uppgiften, dock, är dyrt, jobbigt och ofta ineffektivt. En av de viktigaste utmaningarna är att förstå en särskild klass av proteiner som pryder cellytor, som är målen för de flesta läkemedelsläkemedel.
Nu Wei Liu och hans kollegor vid ASU:s Biodesign Institute, tillsammans med ett team under ledning av Haitao Zhang och Vadim Cherezov från USC har undersökt ett lovande läkemedelsmål i lysande detaljer, använder en enhet som kallas en röntgenfri elektronlaser, eller XFEL.
Deras resultat, som visas i den avancerade onlineutgåvan av tidskriften Natur , kasta nytt ljus över AT2R, en kritisk cellreceptor, vars utbud av funktioner forskare bara har börjat retas ut. Gruppens resultat kan påskynda utvecklingen av nya föreningar som behandlar kardiovaskulära tillstånd, neuropatisk smärta och vävnadstillväxt.
AT2R tillhör en familj av cellreceptorer som kallas GPCR (för G-proteinkopplad receptor), den största familjen av cellmembranreceptorer i det mänskliga genomet. Som Liu förklarar, GPCR är så attraktiva kandidater för att rikta in sig på nya läkemedel eftersom de tillhandahåller väsentliga kommunikationslinjer mellan cellens yttre miljö och dess inre funktion.
"Människor har över 800 GPCR, "Liu säger" och var och en av dem är viktig, eftersom de känner igen tusentals olika enheter utanför cellen, inklusive små molekyler, peptider, proteiner och till och med fotoner. "Det ljuskänsliga GPCR-rhodopsinet, till exempel, är avgörande för synen, luktreceptorer svarar för luktsinnet, medan koffeinet i kaffe verkar genom att binda till adenosinreceptorer, och så vidare.
Förutom deras viktiga hushållsroller, GPCR ger läkemedelsmål för behandling av en myriad av mänskliga sjukdomar. "För nästan alla sjukdomar vi kämpar med, GPCR -proteiner kan vara de potentiella läkemedelsmålen:kemokinreceptorer för HIV, serotoninreceptorer för Alzheimers, dopaminreceptorer för drogberoende och Parkinsons, "Säger Liu.

Experimentstationen Coherent X-ray Imaging (CXI) vid SLAC:s Linac Coherent Light Source (LCLS) röntgenlaser är speciellt utrustad för att studera kristalliserade proteiner i atomskala detaljer. Denna station användes i en studie av angiotensin II AT2 -receptorn bunden till en läkemedelsförening. Kredit:SLAC National Accelerator Laboratory
Med kraftfulla röntgenstrålar från SLAC:s Linac Coherent Light Source (LCLS) och Argonne National Laboratory's Advanced Photon Source (APS), forskare upptäckte nya strukturella detaljer om angiotensin II -receptorn AT2R som har förbryllat forskare i två decennier. AT2R är en av två angiotensin II -receptorer, och dess par, AT1R, har framgångsrikt använts som ett mål för högt blodtrycksmedicin.
Den information som avslöjats av studien kan ge läkemedelsutvecklare en ny väg för föreningar som bekämpar smärta och inflammation eller främjar vävnadsregenerering genom att docka tätt i en ficka i AT2R:s genomarbetade tredimensionella form.
"Till skillnad från sitt syskon AT1R, AT2 -receptorn inte har förståtts helt, "sa Cherezov, professor i kemi vid University of Southern California och huvudutredare av studien. "Genom denna studie avslöjade vi många viktiga detaljer om AT2 -receptorstrukturen och hur den binder till kemiska föreningar, information som kommer att stimulera ytterligare studier av receptorns funktion och som kan möjliggöra ett spännande nästa steg i upptäckten av läkemedel. "
Två receptorer, Många mysterier
Båda angiotensin II -receptorerna, AT1 och AT2, är viktiga komponenter i ett hormonsystem som hjälper till att reglera blodtryck och natriumnivåer i blodet. De är kända som "membranproteiner" eftersom de ligger över cellplasmamembranen, där de tar emot signaler från hormoner utanför cellen och skickar dem vidare till lösliga partners inuti cellen, såsom G-proteiner eller β-arrestiner, startar en kaskad av händelser som sprider signalen i hela cellen.
Många högtrycksmedicin som för närvarande finns på marknaden riktar sig mot AT1-receptorn på grund av dess väl förstådda roll i blodtrycksreglering; de blockerar AT1 för att minska blodtrycket. AT2 -receptorn, å andra sidan, är fortfarande ett svårfångat läkemedelsmål trots flera studier av dess funktion. Vissa, men inte allt, har visat att det motverkar effekterna av AT1; andra pekar på dess potential för vävnadsskydd och regenerering; och ytterligare andra föreslår att det kan spela en roll för att blockera smärta.
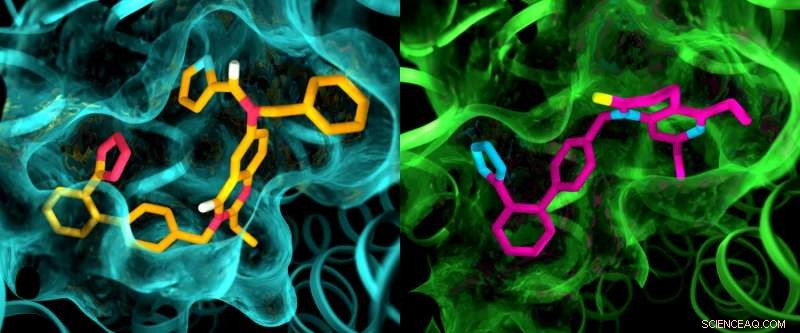
Även om de två angiotensin II -receptorerna anses vara mycket lika, en röntgenstudie visade tydliga skillnader i fickorna där receptorerna binder till läkemedelsliknande föreningar. Denna illustration visar detaljer i fickstrukturerna för AT2 (vänster) och AT1 (höger). Upphovsman:Greg Stewart/SLAC National Accelerator Laboratory
Även om det ännu inte finns några godkända läkemedel som verkar på AT2 -receptorer, läkemedelsföretag driver aggressivt efter föreningar som antingen aktiverar eller blockerar dem. En sådan förening, kallad EMA401, testas på patienter för behandling av neuropatisk smärta.
Den senaste studien behandlar två mål:förstå hur AT2 skiljer sig från AT1, för att selektivt rikta in det; och utforska varför AT2 -som har alla de klassiska funktionerna i en GPCR, precis som AT1 - misslyckas med att aktivera G -proteiner, som sprider signaler inuti cellerna, eller interagera med arrestin, stänga av dessa signaler.
Biologi under röntgenljus
I experimenten, forskarna tittade på två olika typer av prover, som formades till kristaller för undersökning med röntgen. I ett, AT2 -receptorn var bunden till en selektiv förening, en som bara binder till AT2. Dessa kristaller var så små att de bara kunde studeras vid SLAC:s röntgenfria elektronlaser LCLS, där de strömmades över en stråle av ultrasnabba röntgenpulser.
I den andra, en icke-selektiv förening var bunden till både AT1 och AT2. Dessa prover, som bildade större kristaller, undersöktes vid Argonnes APS -synkrotronljuskälla.
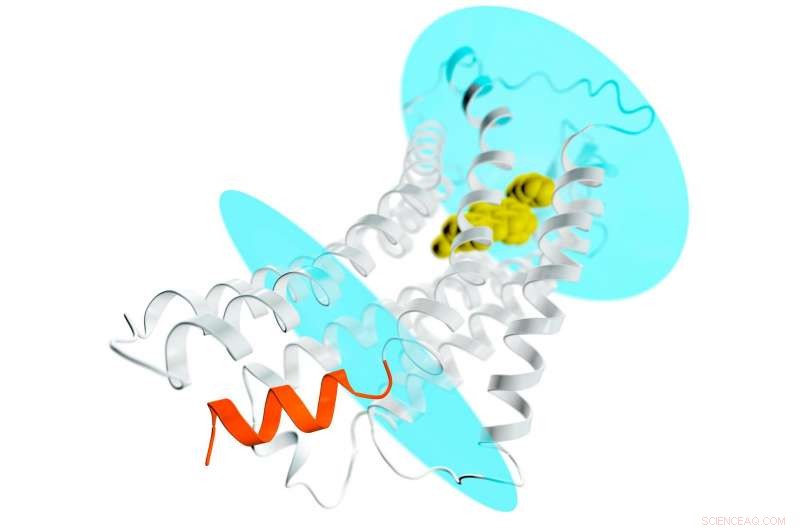
En skildring av AT2 -receptorn (grå spiraler och trådar) som sträcker sig genom ett cellmembran; de blå ovalerna representerar membranets inre och yttre ytor. En potentiell läkemedelsförening är bunden till receptorns yttre ficka (gul) och stabiliserar receptorn i en aktivliknande konformation. Detta skulle normalt leda till aktivering av G-proteiner och spridning av en signal genom cellen. Men när det gäller AT2, platsen där G-proteiner lägger till för att ta emot signalen blockeras av en spiralformad helix (orange) som är en del av receptorn. Denna nya detalj hjälper till att förklara varför AT2-receptorer inte binder och aktiverar G-proteiner, men i stället sannolikt sända signalen inuti cellen via andra ännu okända mekanismer. Upphovsman:Greg Stewart/SLAC National Accelerator Laboratory
Oväntade utfall
Resultaten av experimenten var överraskande på flera sätt. Först, även om båda föreningarna var utformade för att blockera och inaktivera receptorerna, de lämnade AT2 i ett tillstånd som verkade vara aktivt. Dessutom, även om AT1 och AT2 ansågs vara mycket lika, fickorna där receptorerna binder till föreningarna uppvisade markanta skillnader.
"Detta är något vi aldrig har sett med GPCR, "Sade Cherezov." Tanken var alltid att receptorer som binder till samma föreningar skulle ha mycket liknande fickor, så ansträngningar att utveckla läkemedel som verkar på AT2 började med samma grundstrukturer som läkemedel som verkar på AT1. Nu ser vi att vi kanske måste börja med helt andra läkemedelsliknande molekyler som är skräddarsydda för att passa AT2-receptorn, vilket skulle kunna sätta läkemedelsupptäcktsprocessen i en annan riktning. "
ASU -deltagarna hjälpte till med dataanalys samt provberedning och karakterisering. Liu, tidigare medlem i teamet på USC, hjälpte också till med receptorkonstruktion, rening och kristallisation.
Liu betonar att många viktiga GPCR -proteiner lämpliga för läkemedelsmål endast kan bilda mycket små kristaller (under 100 mikron i längd) i laboratoriet. Historiskt sett förmågan att odla stora proteinkristaller i laboratoriet var en förutsättning för att studera deras 3d -struktur vid höga upplösningar, eftersom mindre kristaller skulle förstöras av synkrotronstrålning. Nu dock, studiet av dessa molekyler har revolutionerats genom användning av XFEL -teknik, som utsätter kristallerna i mikronstorlek för så korta strålningsutbrott att de förblir intakta.
ASU är en föregångare inom detta nya studieområde, kombinerar deras expertis i att producera små kristaller som är tillräckliga för analys av GPCR -proteiner med kapacitet att avbilda sådana prover med extremt hög upplösning med XFEL.
Biodesign Institute har nyligen genomfört ett djärvt projekt för att bygga en första i sitt slag kompakt XFEL, som kan utföra denna typ av högupplöst proteinstrukturanalys, radikalt minska kostnaderna och förbättra tillgängligheten. (För närvarande, det finns bara tre stora XFEL -maskiner, SLAC -anläggningen i Stanford, DESY i Hamburg, Tyskland och SACLA XFEL, i Harima, Japan.)
"XFEL öppnar dörren till alla dessa membranproteinmål, "Liu säger, betonar att området för röntgenkristallografi nu är redo för snabba framsteg.