Brasilianska och franska forskare visar att inhibering av interaktionen mellan två nyckelproteiner för cellväggsförlängning kan vara en effektiv strategi för att döda bakterier av typen bacill. Kreditera: Naturkommunikation
I en artikel publicerad i Naturkommunikation den 3 oktober, en grupp forskare från Brasilien och Frankrike beskriver en ny strategi som kan vara användbar för att behandla infektion av läkemedelsresistenta patogener.
Projektet syftar till att öka effektiviteten i bekämpningen av bacillbakterierna – dessa är stavformade eller cylindriska bakterier som inkluderar flera arter som orsakar sjukdomar hos människor, såsom Escherichia coli, Pseudomonas aeruginosa och Helicobacter pylori.
"Våra resultat banar väg för utveckling av antibiotika som har en helt annan verkningsmekanism än den för de läkemedel som används idag, sa Andréa Dessen, koordinator för projektet. Dessen forskar vid Institute of Structural Biology (IBS) i Grenoble, Frankrike, och även vid National Bioscience Laboratory (LNBio) i Campinas, delstaten São Paulo, Brasilien.
Genom att förbättra den vetenskapliga kunskapen om processerna i samband med bildandet av bakteriecellsväggar – halvstyva strukturer som omsluter hela mikroorganismen och är väsentliga för dess överlevnad – undersökte projektet sätt att göra bakterier av typen bacillus mer sårbara och oförmögna att fortplanta sig.
"Cellväggen är ett nät som ett fiskenät som till stor del består av peptidoglykan, en polymeriserad blandning av sockerarter och aminosyror associerade med peptider, "Förklarade Dessen." Det skyddar bakterien mot skillnader i osmotiskt tryck och säkerställer att cellen har rätt form. Den innehåller också olika virulensfaktorer [molekyler som hjälper bakterier att kringgå immunsystemets försvar och infektera värdceller]."
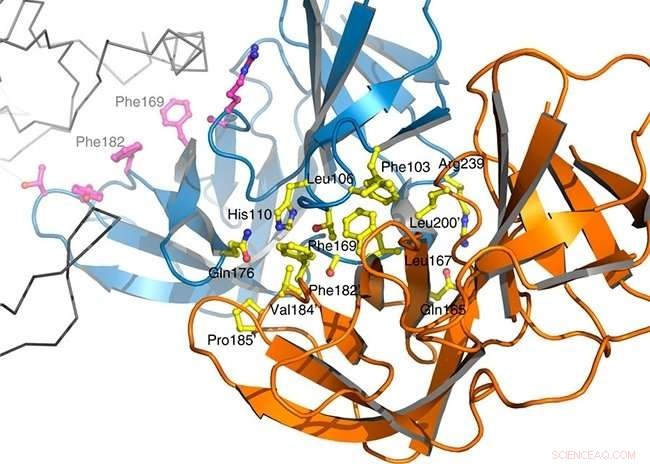
Strax efter celldelning, vissa bacilliproteiner behöver binda för att säkerställa att dotterceller har cellväggar med rätt långsträckt form. Denna bindning bildar ett multiproteinkomplex som kallas elongasomen. Gruppen lyckades för första gången isolera den centrala delen av komplexet som bildas av proteinerna PBP2 och MreC och belysa dess tredimensionella struktur.
Att göra detta, de använde röntgendiffraktionskristallografi, en teknik som består av att kristallisera proteiner och observera hur kristallen sprider en stråle av infallande röntgenstrålar. "På det här sättet, det var möjligt att förstå hur de två molekylerna interagerar och planera sätt att hämma denna interaktion, " sa Dessen.
Nästa steg var att konstruera muterade versioner av MreC med förändringar i aminosyrorna belägna i området för gränssnittet med PBP2. In vitro -analyser visade att det modifierade proteinet inte längre kunde interagera med PBP2 för att bilda komplexet.
Stammar av bakterien H. pylori genetiskt modifierade för att uttrycka mutantproteinet MreC producerades genom samarbete med forskare vid Frankrikes Pasteur -institut. Gruppen fann att när dessa mikroorganismer placerades i en odlingsskål för att växa, de kunde inte förvärva kapselformen och dog snabbt. "Ändringen av MreC påverkade verkligen cellväggens form, ", sade Dessen. "Så experimentet bevisade betydelsen av PBP2-MreC-komplexet för förlängning av väggen och överlevnad av baciller. Denna kunskap kan användas för att söka molekyler som kan avbryta interaktionen mellan dessa proteiner och därigenom döda basillen. "
I princip, strategin är endast effektiv mot arter med långsträckta cellväggar. Denna grupp inkluderar Acinetobacter baumannii, som Världshälsoorganisationen (WHO) anser vara en av de farligaste patogenerna idag eftersom den har förvärvat resistens mot de flesta tillgängliga läkemedel. Ett annat stort hot, enligt Dessen, är arten Klebsiella pneumoniae, som också har en långsträckt. "En kvinna som nyligen lades in på sjukhus i USA dog av infektion av en stam av K. pneumoniae som är resistent mot 26 olika antibiotika. Problemet med läkemedelsresistenta bakterier är allvarligt och har inte uppmärksammats ordentligt av varken regeringar eller läkemedelsindustrin. Vi kan inte längre ignorera det, " sa Dessen.