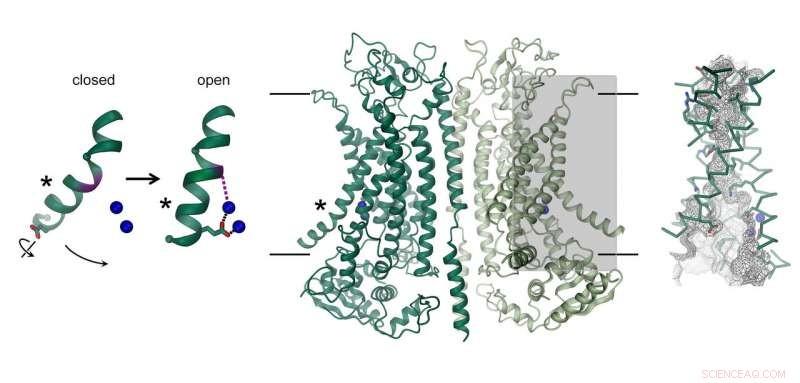
Struktur av den kalciumaktiverade kloridkanalen TMEM16A. Kanalen, som består av två identiska underenheter, visas i mitten. Membranets position indikeras med linjer. Jonledningsporen är markerad (grå rektangel) och visas i detalj till höger. Bilden till vänster visar rörelsen av en α-helix som leder till kanalöppning. Bundna kalciumjoner avbildas som blå sfärer. Kredit:Raimund Dutzler, UZH
Biokemister vid universitetet i Zürich har använt kryo-elektronmikroskopi för att bestämma den detaljerade arkitekturen för kloridkanalen TMEM16A. Detta protein är ett lovande mål för utvecklingen av effektiva läkemedel för att behandla cystisk fibros.
Cystisk fibros är en allvarlig ärftlig sjukdom i lungorna, som det för närvarande inte finns något botemedel mot. Den bakomliggande orsaken till sjukdomen är en funktionsfel i kloridkanalen CFTR, som förhindrar utsöndringen av klorid i vissa kroppsceller. Detta leder till uttorkning av slemskiktet i lungan. Ett lovande tillvägagångssätt för behandling av cystisk fibros är aktiveringen av den kalciumaktiverade kloridkanalen TMEM16A som en alternativ väg för kloridutflöde. Eftersom TMEM16A uttrycks i samma epitel som CFTR, dess aktivering kan återställa hydrering av slemskiktet. TMEM16A är en del av en proteinfamilj vars medlemmar underlättar flödet av negativt laddade kloridjoner eller lipider över cellmembranet.
Strukturen för en kloridkanal bestämd
Strukturen av en TMEM16 scramblase, som fungerar som en lipidtransportör och spelar en viktig roll vid blodkoagulation, var redan känd från tidigare arbete. Forskare vid institutionen för biokemi vid universitetet i Zürich har nu också lyckats dekryptera strukturen av kloridkanalen TMEM16A. Att göra så, teamet ledd av professor Raimund Dutzler använde kryo-elektronmikroskopi (cryo-EM), en teknik vars pionjärer nyligen belönades med Nobelpriset i kemi. "Den molekylära arkitekturen hos detta membranprotein är avgörande för den riktade utvecklingen av läkemedel för behandling av cystisk fibros, " betonar Dutzler.
Upptäckten av en ny aktiveringsmekanism
Kloridkanalen TMEM16A finns i olika organ i kroppen och spelar en nyckelroll i utsöndringen av klorid i lungan, sammandragning av glatta muskler, och uppfattningen av smärta. Hur dess struktur skiljer sig från närbesläktade scramblaser från samma familj och hur proteinet aktiveras av kalcium avslöjades nu genom en kombination av kryo-EM och elektrofysiologi. Medan dess allmänna arkitektur liknar scramblases från samma familj, det finns distinkta skillnader i porregionen belägen i varje subenhet av det dimera proteinet. Scramblaser innehåller en membranexponerad polär fåra, vilket möjliggör diffusion av lipidhuvudgrupper över lipiddubbelskiktet. I kontrast, på samma plats, TMEM16A bildar en timglasformad proteininnesluten kanal, som är stängd i frånvaro av kalcium. Bindningen av positivt laddade kalciumjoner i dess närhet öppnar kanalen och tillåter negativt laddade kloridjoner att tränga igenom membranet. "Denna aktiveringsmekanism är unik, eftersom de bundna kalciumjonerna direkt förändrar strukturen och elektrostatiken för jonpermeationsporen, " förklarar Cristina Paulino, huvudförfattare till studien.
Banar väg för nya terapier
Fynden som beskriver strukturen och funktionen av TMEM16A banar väg för en mekanistisk förståelse av denna viktiga familj av membranproteiner, och de tillhandahåller en lovande mall för att utveckla läkemedel för behandling av cystisk fibros. "Ämnen som leder till aktiveringen av TMEM16A skulle kompensera defekten i utsöndringen av kloridjoner i lungan, " konstaterar Raimund Dutzler.