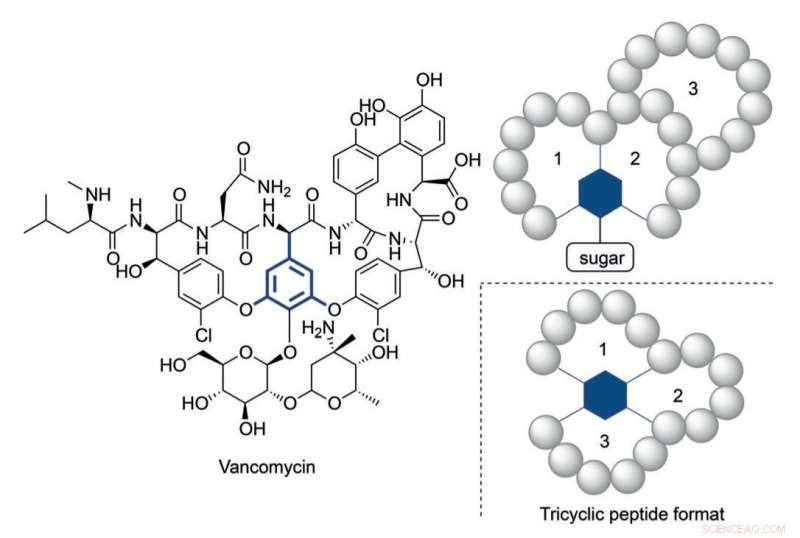
Vancomycins struktur och ett tricykliskt peptidformat inspirerat av dess multicykliska struktur. Kredit:HIMS
Kemister vid University of Amsterdams Van 't Hoff Institute for Molecular Sciences (HIMS) och Pepscan (Lelystad) har utvecklat en ny metod för att låsa linjära peptider i starkt stelnade tricykliska strukturer med farmaceutisk potential. Deras resultat har just rapporterats i Angewandte Chemie .
Metoden, utvecklad av HIMS Ph.D. student Gaston Richelle, möjliggör parallell syntes av flera tricykliska peptider i ett biblioteksformat. Detta medger efterföljande biologisk screening för att identifiera nya peptidterapeutika.
Högre strukturell komplexitet
Under det senaste decenniet har cykliska peptider framträtt som en lovande klass av terapier, visar ett brett terapeutiskt fönster som sträcker sig från antifertilitet till antivirala och cancerbehandlingar. Många monocykliska och bicykliska peptider har identifierats och antalet cykliska peptider som kommer in i kliniska prövningar har ökat drastiskt.
Ändå, det har blivit klart att i vissa fall behövs mer strukturellt komplexa peptider för att nå lämpliga aktivitetsnivåer. Vancomycin, den "sista utväg" tricykliska antibiotika peptiden, ger ett illustrativt exempel på en så komplex konstruktion. Den alarmerande ökande resistensen hos bakterier mot för närvarande tillgängliga antibiotika kräver komplexa peptidkonstruktioner i analogi med vankomycin.
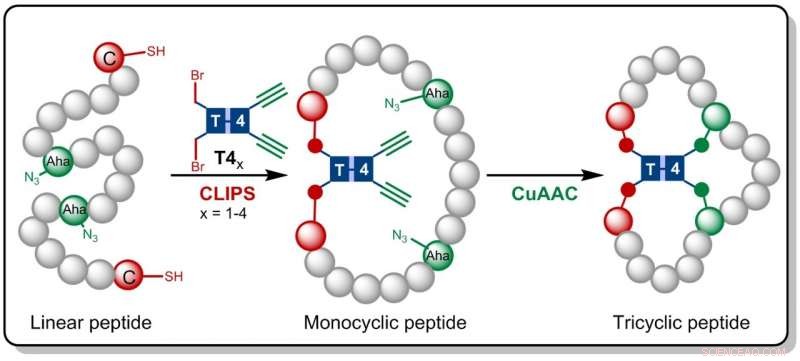
Kredit:HIMS
Sökandet efter nya syntetiska vägar till komplexa multicykliska peptider har således fått allvarligt intresse. Tidigare rapporterade metoder för att skapa multicykliska peptider har varit begränsade på grund av multipel isomerbildning, mödosamma reaktionsprotokoll eller begränsad strukturell mångfald.
CLIPS kombinerat med CuAAC
I forskningen nu publicerad i Angewandte Chemie , Amsterdams kemister bygger på CLIPS -tekniken som tidigare utvecklats på Pepscan. Denna metod för 'kemisk inmatning av peptider på ställningar' ger monocykliska och bicykliska peptider som har visat sig uppvisa förbättrade selektiviteter och affiniteter mot målproteiner.
Gaston Richelle har nu kombinerat CLIPS -metoden med den fullt kompatibla CuAAC -klick -kemin, vilket leder till bildandet av de komplexa tricykliska peptiderna. Genom att använda flexibla ställningsmolekyler, de eftertraktade tricykliska peptiderna bildas på ett isomeriskt rent sätt. Den främsta fördelen med den nya metoden är att CLIPS- och CuAAC-reaktionerna kan utföras i en en-burks procedur utan begränsningar för arten och mängden aminosyror som implementeras i peptidöglorna.
Som ett resultat kan metoden tillämpas i peptidbibliotek med hög mångfald för att generera ett brett spektrum av tricykliska topologier som kan screenas för biologisk aktivitet. För närvarande utförs flera hämningsundersökningar, t.ex. mot enzymer som är mycket rikliga i cancerceller i första steget. Även nya antimikrobiella aktivitetsstudier genomförs mot MRSA och Staphylococcus aureus. Lägg till detta, forskargruppen studerar för närvarande användningen av ännu mer komplexa T6-ställningar för att skapa penta- och hexacykliska peptider.