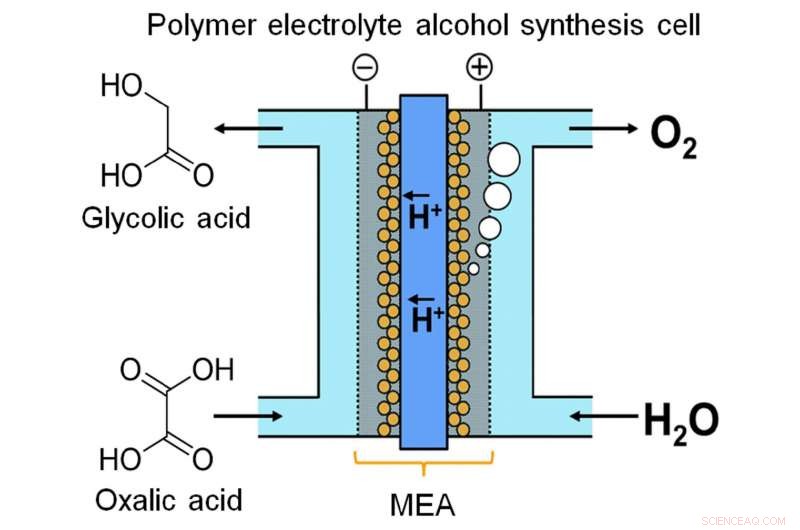
En forskargrupp från Kyushu University realiserade kontinuerlig elektrokemisk syntes av en alkoholförening från en karboxylsyra med hjälp av en polymerelektrolytalkoholelektrosyntescell, som möjliggör direkt kraftladdning till alkoholhaltig förening. Kredit:Masaaki Sadakiyo / Internationella institutet för kolneutral energiforskning, Kyushu universitet
Intresset för förnybar energi fortsätter att växa. Många förnybara energikällor, fastän, kan vara frustrerande intermittent. När solen är skymd av moln, eller så slutar vinden att blåsa, kraften fluktuerar. Den fluktuerande tillgången kan delvis utjämnas genom energilagring under toppproduktionstider. Dock, lagring av el är inte utan sina utmaningar.
Nyligen, ett team vid Kyushu University skapade en enhet för att lagra energi i kemisk form genom kontinuerlig elektrolys. Forskarna noterade att glykolsyra (GC) har en mycket större energikapacitet än väte, en av de mer populära kemikalierna för energilagring. GC kan framställas genom fyrelektronreduktion av oxalsyra (OX), en allmänt tillgänglig karboxylsyra. Som beskrivs i deras publikation i Vetenskapliga rapporter , teamet utarbetade en elektrolytisk cell baserad på en ny membran-elektrodenhet. Mellan två elektroder finns en iridiumoxidbaserad anod och en titandioxid (TiO2)-belagd titan (Ti) katod, länkad av ett polymermembran.
"Flödesliknande system är mycket viktiga för energilagring med vätskefasreaktion, " säger huvudförfattaren Masaaki Sadakiyo. "De flesta elektrolysatorer som producerar alkoholer använder en batchprocess, som inte är lämplig för detta ändamål. I vår enhet, genom att använda en fast polymerelektrolyt i direkt kontakt med elektroderna, vi kan köra reaktionen som ett kontinuerligt flöde utan tillsats av föroreningar (t.ex. elektrolyter). OX-lösningen kan effektivt ses som en flytbar elektronpool."
En annan viktig faktor är katoddesignen. Den katodiska reaktionen katalyseras av anatas TiO2. För att säkerställa en solid koppling mellan katalysator och katod, laget "odlade" TiO2 direkt på Ti i form av ett nät eller filt. Elektronmikroskopbilder visar TiO2 som en trasig ludd, klamrar sig fast på utsidan av Ti-stavarna som en beläggning av nysnö. Faktiskt, dess uppgift är att katalysera elektroreduktionen av OX till GC. Under tiden, vid anoden, vatten oxideras till syre.
Teamet fann att reaktionen accelererade vid högre temperaturer. Dock, Att höja värmen för högt uppmuntrade en oönskad biprocess - omvandlingen av vatten till väte. Den ideala balansen mellan dessa två effekter var vid 60°C. Vid denna temperatur, enheten skulle kunna optimeras ytterligare genom att bromsa flödet av reaktanter, samtidigt som mängden tillgänglig ytarea för reaktionen ökar.
Intressant, till och med strukturen på den luddiga TiO2-katalysatorn gjorde stor skillnad. När TiO2 framställdes som en "filt, "genom att odla den på tunnare och tätare packade Ti-stavar, reaktionen skedde snabbare än på nätet – förmodligen på grund av den större ytan. Filten motverkade också väteproduktion, genom att täcka Ti-ytan tätare än nätet, förhindra exponering av bar Ti.
"Under de rätta förhållandena, vår cell omvandlar nästan 100 procent av OX, vilket vi tycker är mycket uppmuntrande, " säger medförfattaren Miho Yamauchi. "Vi beräknar att den maximala volymetriska energikapaciteten för GC-lösningen är cirka 50 gånger den för vätgas. För att vara tydlig, energieffektiviteten, i motsats till kapacitet, släpar fortfarande efter andra tekniker. Dock, detta är ett lovande första steg till en ny metod för att lagra överskottsström."