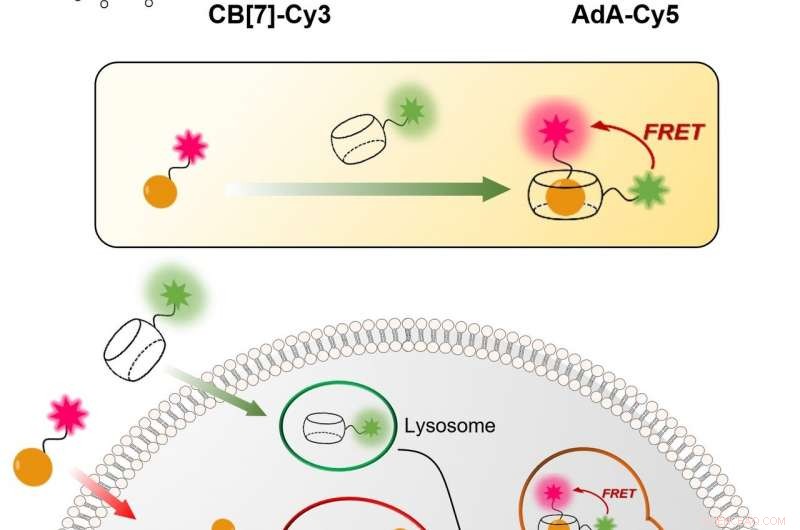
Figur 1:Relativt enkel och billig teknik för att visualisera den cellulära återvinningsmekanismen (autofagi) i realtid. Processen är baserad på bindningen mellan CB[7] och AdA. CB[7] är bundet till det fluorescerande färgämnet Cy3 (färgat i grönt) och går in i lysosomerna, medan AdA är bundet till den fluorescerande Cy5 (färgad i rött) som ackumuleras i mitokondrier. I autofagiprocessen, de två cellulära organellerna smälter samman, leder till mötet mellan CB[7] och AdA. Forskarna kan upptäcka fusionen, för när de två fluorescerande färgämnena rör sig närmare, de interagerar med varandra via fluorescensresonansenergiöverföringsmekanismen (FRET). På det här sättet, forskargruppen kan analysera autofagiprocessen steg för steg. Kredit:Institutet för grundvetenskap
Ett team av forskare vid Centrum för självmontering och komplexitet, inom Institute for Basic Science (IBS) har observerat en normal fysiologisk process, kallas "självätande", som celler använder för att återvinna sina komponenter. De utvecklade en exakt teknik som visualiserar hur mitokondrier, cellernas energifabriker, är sammansmälta med lysosomer, cellers återvinningsmaskiner, för att få material förstört och återvunnet. Eftersom oegentligheter i denna mekanism kan leda till Alzheimers, Parkinsons, och andra komplikationer, denna forskning kan hjälpa framtida framsteg inom diagnostik av degenerativ hjärnsjukdom och läkemedelsutveckling. Studien publicerades i Angewandte Chemie International Edition .
Namnet "autofagi" kommer från det grekiska språket och betyder "självätande". Hur konstigt det än låter, det är en oumbärlig process som används för att rengöra celler från skadade organeller och proteiner. Inuti lysosomer, gamla cellulära delar bryts ner till sina byggstenar, som används för att bygga nya. Nyligen, autofagi blev ett mycket aktivt studieområde och stod i centrum för Yoshinori Ohsumis Nobelpris i fysiologi eller medicin 2016.
Ett exempel på cellulära organeller som regelbundet måste återvinnas är mitokondrien. En noggrann reglering av denna process är avgörande, och celler som inte delar sig regelbundet, som nervceller, är särskilt utsatta. Om celler ackumulerar defekta mitokondrier, de kan skada sig själva. Detta inträffar, till exempel, vid Alzheimers och Parkinsons sjukdomar, där uppbyggnad av skadade mitokondrier och aggregerade proteiner leder till neuronal död.
Det är känt att autofagi (eller mitofagi, i det specifika fallet med mitokondrier) sker genom fusion av två olika organeller, i detta fall:mitokondrier och lysosomer. Dock, att observera beteendet och fusionen av mitokondrier och lysosomer inuti cellerna har varit utmanande. Hittills, de flesta av dessa studier bygger på fluorescerande proteiner fästa vid en organell, vilket gör att forskarna bara kan observera en organell åt gången. Dessutom, fluorescerande proteiner i sig bryts ned under autofagi, vilket gör det svårt att noggrant studera mekanismen.
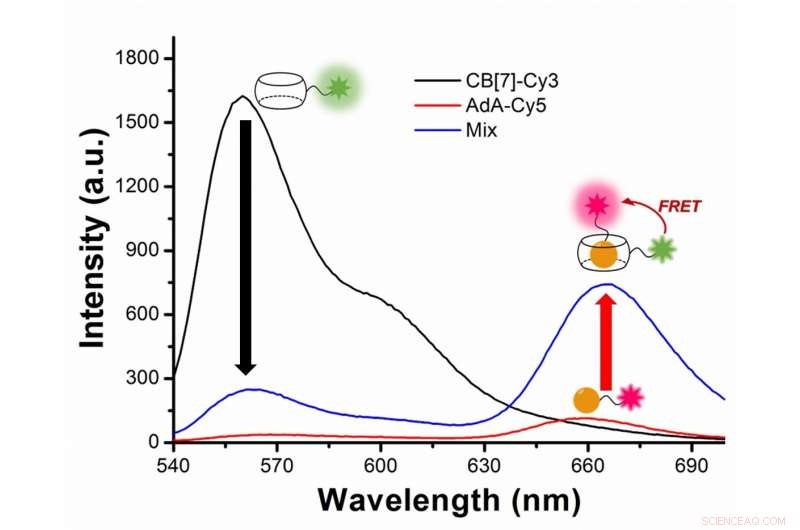
Figur 2:Studera autofagi med fluorescensresonansenergiöverföring (FRET) mellan det grönaktiga fluorescerande färgämnet Cy3 och det röda fluorescerande färgämnet Cy5. Cy3 avger fluorescens med en toppvåglängd vid 563 nanometer (svart linje), medan Cy5 vid 670 nanometer (röd linje). I experimentet, Cy3 är kopplad till CB[7] och Cy5 till AdA. Under autofagi, de två färgämnena kommer närmare och Cy3 överför lite energi till sitt närliggande partnerfärgämne Cy5, efter FRET-fenomenet. Forskarna fångar mötet mellan de två färgämnena som en ökning av fluorescens med våglängd 644-800 nanometer (blå linje). Kredit:Institute for Basic Science
IBS-forskare vid POSTECH utarbetade en kvantitativ procedur för att visualisera både mitokondrier och lysosomer över tid. Den relativt enkla och billiga tekniken är mer exakt än de nuvarande. Den använder ihåliga tunnformade syntetiska molekyler, känd som cucurbituril (CB[7]), som binder med exceptionellt hög bindningsstyrka till en molekyl som kallas adamantylamin (AdA) och inte kan brytas ned av lysosomerna. CB [7] dekorerades med ett fluorescerande färgämne (Cy3), medan AdA med ett annat färgämne (Cy5). Initialt, CB [7] -Cy3 kommer in i lysosomerna och Ada-Cy5 mitokondrierna, och då, när de två organellerna smälter samman i återvinningsprocessen, CB[7]-Cy3 och Ada-Cy5 binder samman. På det här sättet, forskargruppen följde beteendet hos olika organeller och observerade den mitofagiprocess som inträffade i levande celler. Dessutom, experimenten visade att de två föreningarna inte är toxiska för cellerna under en dos på 800 nanomolar.
"Den mest utmanande delen av experimentet var valet av kemikalier. Vi valde kemikalier med rätt hydrofilicitet, avgift, och molekylstorlek för att selektivt införlivas i mitokondrier och lysosomer, " förklarar PARK Kyeng Min, en av motsvarande författare till studien.
I mer tekniska termer, Nyheten i detta dokument är beroende av tillämpningen av fluorescensresonans energiöverföring (FRET) till studien av autofagi. FRET är en avståndsberoende överföring av energi mellan två olika fluorescerande färgämnen; i detta fall Cy3 och Cy5. När de två är tillräckligt nära, Cy3 donerar energi till Cy5. Forskarna fångar mötet mellan de två färgämnena eftersom överföringen av energi från Cy3 till Cy5 leder till en minskning av Cy3-fluorescensintensiteten till förmån för en ökning av Cy5-emissionsintensiteten.
I framtiden, en liknande teknik kan användas för att studera autofagiprocesser som involverar andra cellulära organeller, som proteinfabrikerna Golgi-apparat och endoplasmatiskt retikulum.