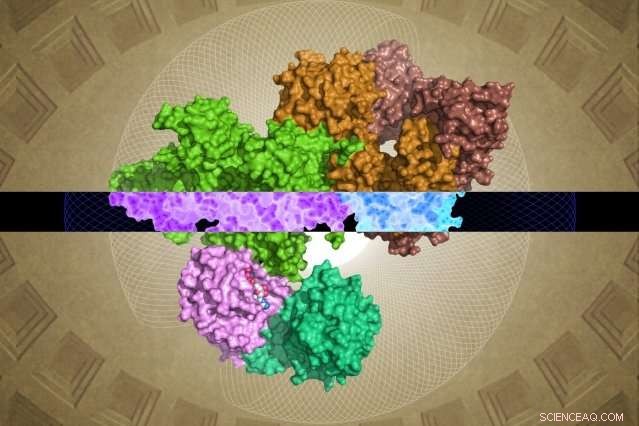
Den cryo-EM-genererade GATOR1-strukturen kan ge insikter om dess funktion. Upphovsman:Steven Lee/Whitehead Institute
Ett team av forskare från Whitehead Institute och Howard Hughes Medical Institute har avslöjat strukturen hos ett nyckelproteinkomplex hos människor som överför signaler om näringsnivåer, gör det möjligt för celler att anpassa sin tillväxt till tillgången på material som behövs för att stödja denna tillväxt. Detta komplex, kallad GATOR1, fungerar som en slags av / på-omkopplare för signalerna "växa" (eller "växer inte") som flödar genom en kritisk cellväxtväg som kallas mTORC1.
Trots dess betydelse, GATOR1 har liten likhet med kända proteiner, lämnar stora luckor i forskarnas förståelse av dess molekylära struktur och funktion. Nu, som beskrivs online den 28 mars i tidningen Natur , Whitehead -forskare och deras kollegor har genererat den första detaljerade molekylära bilden av GATOR1, avslöjar en mycket ordnad grupp proteiner och en extremt ovanlig interaktion med sin partner, Rag GTPase.
"Om du vet något om ett proteins tredimensionella struktur, då kan du göra några informerade gissningar om hur det kan fungera. Men GATOR1 har i princip varit en svart låda, säger seniorförfattaren David Sabatini, medlem i Whitehead Institute, professor i biologi vid MIT, och utredare med Howard Hughes Medical Institute (HHMI). "Nu, för första gången, Vi har genererat högupplösta bilder av GATOR1 och kan börja dissekera hur detta kritiska proteinkomplex fungerar. "
GATOR1 identifierades första gången för ungefär fem år sedan. Den består av tre proteinunderenheter (Depdc5, Nprl2, och Nprl3), och mutationer i dessa underenheter har associerats med mänskliga sjukdomar, inklusive cancer och neurologiska tillstånd som epilepsi. Dock, på grund av bristen på likhet med andra proteiner, majoriteten av GATOR1 -komplexet är ett molekylärt mysterium. "GATOR1 har inga väldefinierade proteindomäner, "förklarar Whitehead -forskaren Kuang Shen, en av studiens första författare. "Så, detta komplex är verkligen ganska speciellt och också mycket utmanande att studera. "
På grund av komplexets stora storlek och relativa flexibilitet, GATOR1 kan inte lätt kristalliseras - ett nödvändigt steg för att lösa proteinstruktur genom standard, Röntgenkristallografiska metoder. Som ett resultat, Shen och Sabatini vände sig till HHMI:s Zhiheng Yu. Yu och hans team är specialiserade på kryo-elektronmikroskopi (cryo-EM), en framväxande teknik som lovar att visualisera molekylstrukturerna hos stora proteiner och proteinkomplex. Viktigt, den använder inte proteinkristaller. Istället, proteiner fryses snabbt i ett tunt lager av förglasad is och avbildas sedan av en stråle av snabba elektroner inuti en elektronmikroskopkolonn.
"Det har varit några stora framsteg inom cryo-EM-teknik under det senaste decenniet, och nu, det är möjligt att uppnå atom- eller nära atomupplösning för en mängd olika proteiner, "förklarar Yu, en senior författare av tidningen och chef för HHMI:s delade, toppmodern cryo-EM-anläggning på Janelia Research Campus. Förra årets Nobelpris i kemi tilldelades tre forskare för deras banbrytande insatser för att utveckla cryo-EM.
GATOR1 visade sig vara ett knepigt ämne, även för cryo-EM, och krävde lite prov-och-fel från Yus sida, Shen, och deras kollegor för att förbereda prover som kan ge robust strukturell information. Dessutom, teamets arbete försvårades ännu mer av komplexets unika form. Utan inslag av GATOR1:s potentiella struktur, Shen och hans kollegor, inklusive medförfattare Edward Brignole från MIT, var tvungen att få det helt från grunden.
Ändå, Whitehead-HHMI-teamet kunde lösa nästan fullständiga strukturer för GATOR1 såväl som för GATOR1 bundna till sina partnerproteiner, Rag GTPases. (Två regioner i subenheten Depdc5 är mycket flexibla och kan därför inte lösas.) Från denna mängd nya information såväl som från teamets efterföljande biokemiska analyser, några överraskande fynd framkom.
Först är den anmärkningsvärda organisationsnivån för GATOR1. Proteinet är extremt välorganiserat, vilket är ganska ovanligt för proteiner som inte har några förutsagda strukturer. (Sådana proteiner är vanligtvis ganska oorganiserade.) Dessutom har forskarna identifierade fyra proteindomäner som aldrig tidigare har visualiserats. Dessa nya motiv - som heter NTD, SABA, SHEN, och CTD - kan ge avgörande inblick i det inre arbetet i GATOR1 -komplexet.
Shen, Sabatini, och deras kollegor avslöjade en annan överraskning. Till skillnad från andra proteiner som binder till Rag GTPases, GATOR1 kontaktar dessa proteiner på minst två distinkta platser. Dessutom, en av bindningsställena tjänar till att hämma - snarare än att stimulera - aktiviteten hos Rag GTPase. "Denna typ av dubbelbindning har aldrig observerats - det är mycket ovanligt, "Säger Shen. Forskarna antar att denna funktion är en anledning till att GATOR1 är så stor - eftersom den måste hålla sin Rag GTPase på flera platser, snarare än en, som de flesta andra proteiner av denna typ gör.
Trots dessa överraskningar, forskarna erkänner att deras analyser bara har börjat repa ytan på GATOR1 och de mekanismer genom vilka den reglerar mTOR -signalvägen.
"Det finns mycket kvar att upptäcka i detta protein, Säger Sabatini.
Denna artikel publiceras på nytt med tillstånd av MIT News (web.mit.edu/newsoffice/), en populär webbplats som täcker nyheter om MIT -forskning, innovation och undervisning.