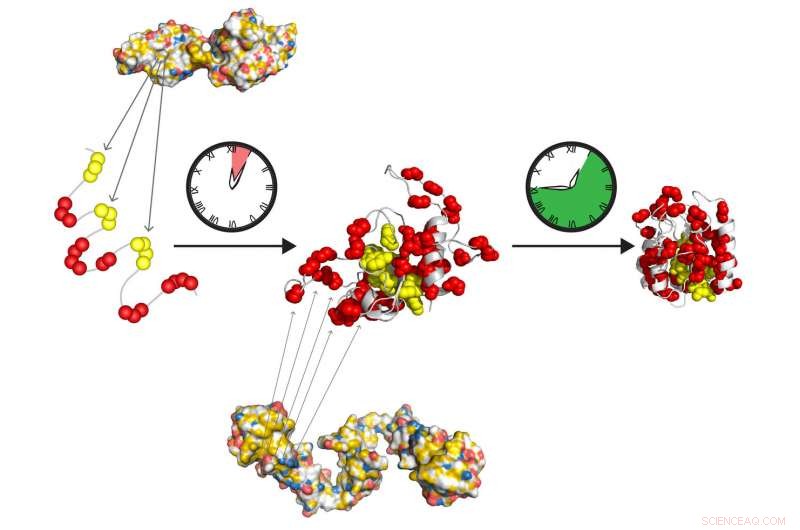
De molekylära chaperonerna Hsp70 och Hsp90 bildar ett snabbverkande reläteam för att på egen hand förbereda proteiner för att vikas till sitt aktiva tillstånd. Hsp70 känner igen korta hydrofoba sträckor (gul), exponeras i det ovikta proteinet. Hsp90 verkar nedströms från Hsp70 och underlättar formningen av vikningsmellanrummet, som långsamt förvandlas till det ursprungliga tillståndet, fri från ytterligare följeslagare. Kredit:Tania Morán Luengo och Stefan Rüdiger, Utrecht universitet
Cellulära proteiner produceras som långa kedjor av aminosyror som måste vikas exakt till sin slutliga form. Nyckelaktörerna i denna vikningsprocess är de så kallade molekylära chaperonerna, proteinhjälpare som ser till att denna process blir framgångsrik. Forskare från Utrecht University, i nära samarbete med kollegor från Heidelbergs universitet, har äntligen avslöjat hur de två viktigaste chaperonefamiljerna, Hsp70 och Hsp90, samarbeta i denna vikningsprocess. Förvånande, det visar sig att de inte aktivt hjälper till med vikningen, som forskarna länge antagit. Istället, de förbereder helt enkelt proteinerna för spontana, produktiv vikning. Detta genombrott för att förstå hur Hsp70-Hsp90-kaskaden fungerar kommer att publiceras i Molekylär cell den 3 maj.
Felaktigt vikta proteiner kan resultera i allvarliga sjukdomar som cystisk fibros och många neurodegenerativa sjukdomar som Alzheimers. Forskare har länge vetat att Hsp70 och Hsp90 spelar en nyckelroll i denna vikningsprocess, och att Hsp90 verkar nedströms Hsp70. Dock, den faktiska mekanismen genom vilken de viker ett protein har förblivit gåtfull.
Ph.D. kandidat Tania Morán Luengo från Utrecht University har nyligen visat att chaperonen Hsp70 binder till det unga proteinet, skyddar den samtidigt som den förhindrar att den viker sig. Sedan bryter Hsp90 Hsp70-blocket, vilket gör att proteinet kan fortsätta att vikas till rätt tillstånd helt av sig själv. Denna upptäckt signalerade det överraskande slutet på den långvariga tron att chaperones viker proteiner.
Forskningsledaren Dr Stefan Rüdiger från Utrecht University fick en glimt av denna nya idé när han förberedde sig för att undervisa i en kurs om ämnet. Hsp70 binder till hydrofoba aminosyror, skyddar dem från att klibba ihop tills de är gömda inuti den slutliga proteinstrukturen. Han insåg att sättet Hsp70 binder till sina substrat därför inte kunde bidra till proteinveckning, utan snarare hämmar det istället.
Forskarna började sedan analysera vikningsprocessen, observerar att koncentrationer av Hsp70 i intervallet för de som finns i våra celler hämmade proteinveckning. "Detta drog slutsatsen att Hsp70 inte är en promotor, men i själva verket en effektiv hämmare av veckningsprocessen, " Rüdiger förklarar. Hans grupp slog sig ihop med professor Matthias Mayers laboratorium vid Heidelbergs universitet för att testa denna hypotes experimentellt. De visade att närvaron av Hsp90 vid denna tidpunkt är avgörande för att veckningsprocessen ska inträffa. Hsp90 gör det möjligt för proteinet att gå sönder. ur Hsp70 dödläge för att vika i sin rätta form på egen hand.
Molecular Cell välj en illustration av denna forskning för dess omslag. Konstverket gjordes av forskningsledare Stefan Rüdiger (akryl på duk). Det representerar att de bevarade Hsp70- och Hsp90-chaperonerna bildar en kaskad som bara är aktiv i den första, glödheta minuter av vikningsprocessen. Den efterföljande passagen genom leden till det inhemska tillståndet är lång och långsam - och fri från störningar av chaperoner. Kredit:Molecular Cell / Stefan Rüdiger, Utrecht universitet
"Denna stopp-start-mekanism är bevarad från bakterier till människa, " Rüdiger säger. "Många sjukdomar är beroende av den slutliga aktiva formen av proteiner. Således, forskare som arbetar med terapier som är inriktade på veckningsprocessen vet äntligen vad de ska leta efter."