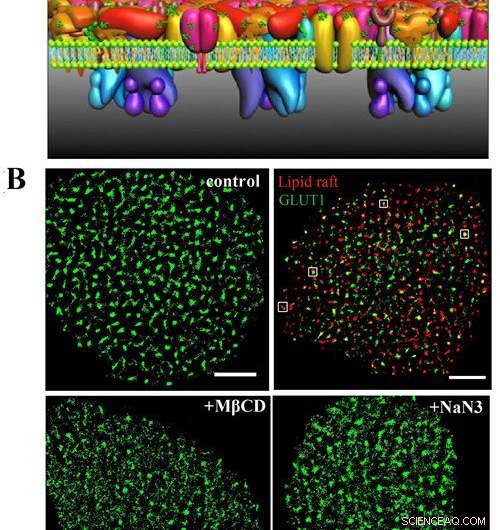
A) Detta är PLLPI -modellen för cellmembranet. B) dSTORM -bilder av GLUT1 på cellmembranet; GLUT1 och lipidflottor; och GLUT1 -distribution efter MβCD- och NaN3 -behandling. Skalstänger, 5 μm. Upphovsman:GAO Jing
Glukos är den primära energikällan och substratet för celler, och dess upptag genom cellplasmamembranet är till stor del beroende av glukostransportfamiljen (GLUT). GLUT1, en av GLUT -familjemedlemmarna, är ett allestädes närvarande uttryckt membranprotein. Det är ansvarigt för konstant upptag av glukos i många vävnader.
Yan et al. rapporterade kristallstrukturen för mänsklig GLUT1 vid 3,2 ångström upplösning 2014. Men den detaljerade fördelningen av GLUT1 på nativa cellmembran var inte klar, och hur proteinorganisationer kopplar till sina fysiologiska funktioner var okända. Med modifieringen och uppdateringen av cellmembranstrukturen, många studier har funnit den heterogena och klusterande fördelningen av membranproteiner.
En färsk proteinlager-lipid-protein-ö (PLLPI) membranmodell betonade att ett tätt proteinskikt bildades på den ektoplasmatiska sidan av membranet och dispergerade proteinmikrodomäner bildade på den cytoplasmatiska sidan. För att ta itu med fördelningskarakteristika och de bakomliggande organisationsmekanismerna för GLUT1, superupplöst fluorescensmikroskopi har gett ett särskilt lämpligt verktyg. Det bryter diffraktionsbarriären och uppnår en lateral upplösning i tiotals nanometer. Det är mycket lämpligt för att direkt övervaka storleken och stabiliteten hos proteinaggregationer.
Prof. WANG Hongda från Changchun Institute of Applied Chemistry, Chinese Academy of Sciences och professor XIONG Wenyong från Kunming Institute of Botany, tillsammans med sina teammedlemmar, undersökte först distribution och montering av GLUT1 vid en nanometerupplösning genom direkt stokastisk optisk rekonstruktionsmikroskopi (dSTORM).
De fann att transportören bildade kluster med en medeldiameter på ~ 250 nm på HeLa -cellmembran. Det fanns en exakt rumslig koppling mellan GLUT1 och lipidflottor, som löste debatten kring transportörens lokalisering i membrandomäner.
När det gäller den organisatoriska mekanismen för GLUT1 -kluster, de avslöjade att inte bara lipidflottarnas miljö kan stabilisera deras existens, men aktincytoskelet och N-glykosylering spelar också viktiga roller i klusterbildningen.
Dessutom, de fann att aktiveringen av GLUT1 med natriumazid eller MβCD inte ökade dess membranuttryck utan inducerade minskningen av de stora klustren.
Resultaten föreslog en potentiell koppling mellan distribution och aktivering. Deras lagarbete kan utgöra ett steg framåt i vår förståelse av den molekylära mekanismen för GLUT -gruppering och glukosupptag.