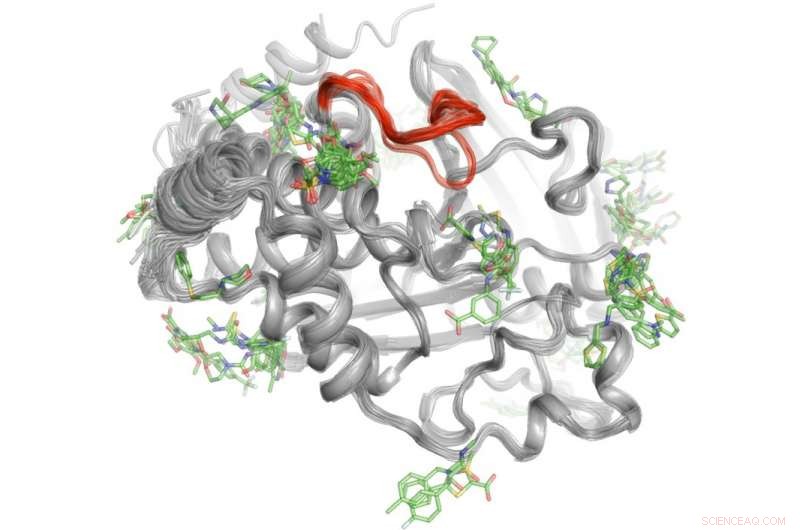
En metod med hög genomströmning avslöjar var över 100 små molekyler binder till proteinet PTP1B. Ett fåtal utvalda av dessa bindningsområden kan skicka signaler till den aktiva platsen (röd) för att kontrollera PTP1B:s aktivitet." Kredit:Daniel Keedy
Proteinerna i våra kroppar är sofistikerade strukturer som utför specifika jobb för att hålla oss fungerande och friska. I många fall, dessa små maskiner slås på eller av genom en tvåstegsprocess där en del av proteinet skickar meddelanden till en annan del som kallas den "aktiva platsen, " triggar proteinet att starta eller sluta sitt jobb. Ibland störs denna process, känd som allosteri, som leder till eller bidrar till utvecklingen av vissa sjukdomar.
Att förstå hur ett protein är kopplat kan hjälpa forskare att utveckla sätt att kontrollera dess aktivitet, och forskare vid Advanced Science Research Center (ASRC) vid The Graduate Center, KUNIG, tror att de har kommit på ett tillförlitligt sätt att avgöra detta, enligt en nyligen publicerad studie i eLife .
"Precis som det är svårt att gissa hur en ljusströmbrytare är kopplad till en glödlampa i ett rum utan att se bakom väggarna, det är svårt att förutsäga vilket avlägsna område av ett protein som är kopplat till dess aktiva plats utan att se detaljerna inuti strukturen, sa Daniel Keedy, biträdande professor med ASRC:s Structural Biology Initiative och med The City College of New Yorks kemi- och biokemiavdelningar.
För att lösa detta mysterium, Keedy och hans kollegor utforskade signaleringsförmågan hos proteintyrosinfosfatas 1B (PTP1B), som forskare tror spelar en betydande roll vid typ 2-diabetes och eventuellt bröstcancer. De använde först röntgenkristallografi vid olika temperaturer för att se hur atomer inuti proteinet rör sig. Detta avslöjade specifika områden där atomerna rör sig som vindrutetorkare eller en Newtons vagga leksak för att skicka meddelanden. Nästa, teamet utförde experiment med hög genomströmning med proteinet för att avgöra vilka små molekyler som binder till dessa signaleringsställen.
"Denna tvåstegsprocess gjorde att vi inte bara kunde se var signaleringen kommer från PTP1B, men också vilka små molekyler som kan skicka meddelanden till den aktiva platsen. Denna kunskap kan en dag hjälpa oss att utveckla terapier som skickar specifika budskap för att kontrollera ett proteins aktivitet och störa utvecklingen av typ 2-diabetes, " sa Keedy.
"Jag är väldigt förtjust i de potentiella tillämpningarna av Daniels arbete, sa Kevin Gardner, chef för ASRC:s Structural Biology Initiative och Einstein professor i kemi och biokemi vid City College. "Denna teknik ger en kraftfull experimentell väg för att fråga var små molekyler kan binda till proteinmål, möjliggör upptäckt och utveckling av läkemedel genom att visa var man kan hitta tidigare oväntade "fotfästen" för föreningar för att binda och kontrollera proteinaktivitet."
Keedy och hans kollegor har hittills bara tittat på PTP1B, men deras metod använder sig av lättillgängliga teknologier som kan användas för att studera allosteriprocessen i många andra viktiga proteiner i våra kroppar. De hoppas få en ny förståelse för hur funktionerna hos dessa andra proteiner kontrolleras, vilket kan vara användbart för framtida utveckling av nya läkemedelsterapier.