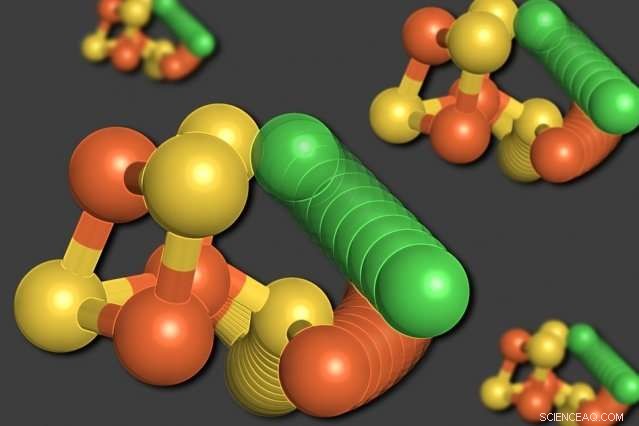
MIT-forskare har visat att några av atomerna i ett enzym som kallas kolmonoxiddehydrogenas kan ordna om sig själva när syrenivåerna är låga. En nickelatom (grön) lämnar den kubliknande strukturen, ersätta en järnatom (orange). En svavelatom (gul) rör sig också ut ur kuben. Kredit:Elizabeth Wittenborn
Många mikrober har ett enzym som kan omvandla koldioxid till kolmonoxid. Denna reaktion är kritisk för att bygga kolföreningar och generera energi, speciellt för bakterier som lever i syrefria miljöer.
Detta enzym är också av stort intresse för forskare som vill hitta nya sätt att ta bort växthusgaser från atmosfären och omvandla dem till användbara kolhaltiga föreningar. Nuvarande industriella metoder för att omvandla koldioxid är mycket energikrävande.
"Det finns industriella processer som utför dessa reaktioner vid höga temperaturer och höga tryck, och sedan finns det detta enzym som kan göra samma sak vid rumstemperatur, säger Catherine Drennan, en MIT-professor i kemi och biologi och en utredare vid Howard Hughes Medical Institute. "Under en lång tid, människor har varit intresserade av att förstå hur naturen utför denna utmanande kemi med denna sammansättning av metaller."
Drennan och hennes kollegor vid MIT, Brandeis universitet, och Aix-Marseille University i Frankrike har nu upptäckt en unik aspekt av strukturen av "C-klustret" - samlingen av metall- och svavelatomer som utgör hjärtat av enzymet kolmonoxiddehydrogenas (CODH). Istället för att bilda en styv ställning, som förväntat, klustret kan faktiskt ändra sin konfiguration.
"Det var inte vad vi förväntade oss att se, " säger Elizabeth Wittenborn, en färsk MIT Ph.D. mottagare och huvudförfattare till studien, som visas i tidningen 2 oktober eLife .
Ett molekylärt vagnhjul
Metallhaltiga kluster som C-klustret utför många andra kritiska reaktioner i mikrober, inklusive delning av kvävgas, som är svåra att replikera industriellt.
Drennan började studera strukturen av kolmonoxiddehydrogenas och C-klustret för cirka 20 år sedan, strax efter att hon startade sitt labb vid MIT. Hon och en annan forskargrupp kom fram till en struktur för enzymet med hjälp av röntgenkristallografi, men strukturerna var inte riktigt desamma. Skillnaderna löstes så småningom och strukturen för CODH ansågs vara väletablerad.
Wittenborn tog upp projektet för några år sedan, i hopp om att förstå varför enzymet är så känsligt för inaktivering av syre och bestämma hur C-klustret sätts ihop.
Till forskarnas förvåning, deras analys avslöjade två olika strukturer för C-klustret. Den första var ett arrangemang som de hade förväntat sig att se - en kub bestående av fyra svavelatomer, tre järnatomer, och en nickelatom, med en fjärde järnatom kopplad till kuben.
I den andra strukturen, dock, nickelatomen avlägsnas från den kubliknande strukturen och ersätter den fjärde järnatomen. Den förskjutna järnatomen binder till en närliggande aminosyra, cystein, som håller den på sin nya plats. En av svavelatomerna rör sig också ut ur kuben. Alla dessa rörelser verkar förekomma i samklang, i en rörelse beskriver forskarna som ett "molekylärt vagnhjul".
"Svavel, järnet, och nickeln flyttar alla till nya platser, Drennan säger. "Vi blev verkligen chockade. Vi trodde att vi förstod detta enzym, men vi fann att den gör denna otroligt dramatiska rörelse som vi aldrig förutsåg. Sedan kom vi med fler bevis på att det här faktiskt är något som är relevant och viktigt - det är inte bara en jävla sak utan en del av utformningen av detta kluster. "
Forskarna tror att denna rörelse, som uppstår vid syreexponering, hjälper till att skydda klustret från att helt och irreversibelt falla isär som svar på syre.
"Det verkar som att det här är ett skyddsnät, så att metallerna kan flyttas till platser där de är säkrare på proteinet, " säger Drennan.
Douglas Rees, en professor i kemi vid Caltech, beskrev uppsatsen som "en vacker studie av en fascinerande klusterkonverteringsprocess."
"Dessa kluster har mineralliknande egenskaper och man kan tro att de skulle vara" lika stabila som en sten, " säger Rees, som inte var involverad i forskningen. "Istället, klustren kan vara dynamiska, som ger dem egenskaper som är avgörande för deras funktion i en biologisk miljö."
Inte en stel ställning
Detta är det största metallskiftet som någonsin har setts i något enzymkluster, men mindre omarrangemang har setts i vissa andra, inklusive ett metallkluster som finns i enzymet nitrogenas, som omvandlar kvävgas till ammoniak.
"Förr, folk tänkte på dessa kluster som verkligen dessa stela ställningar, men bara under de senaste åren kommer det allt fler bevis på att de inte är riktigt styva, " säger Drennan.
Forskarna försöker nu ta reda på hur celler sätter ihop dessa kluster. Lär dig mer om hur dessa kluster fungerar, hur de sätts ihop, och hur de påverkas av syre kan hjälpa forskare som försöker kopiera sin åtgärd för industriellt bruk, Drennan säger. Det finns ett stort intresse för att komma på sätt att bekämpa ackumulering av växthusgaser genom att till exempel, omvandlar koldioxid till kolmonoxid och sedan till acetat, som kan användas som byggsten för många typer av användbara kolhaltiga föreningar.
"Det är mer komplicerat än vad folk trodde. Om vi förstår det, då har vi en mycket bättre chans att verkligen efterlikna det biologiska systemet, " säger Drennan.
Den här historien återpubliceras med tillstånd av MIT News (web.mit.edu/newsoffice/), en populär webbplats som täcker nyheter om MIT-forskning, innovation och undervisning.