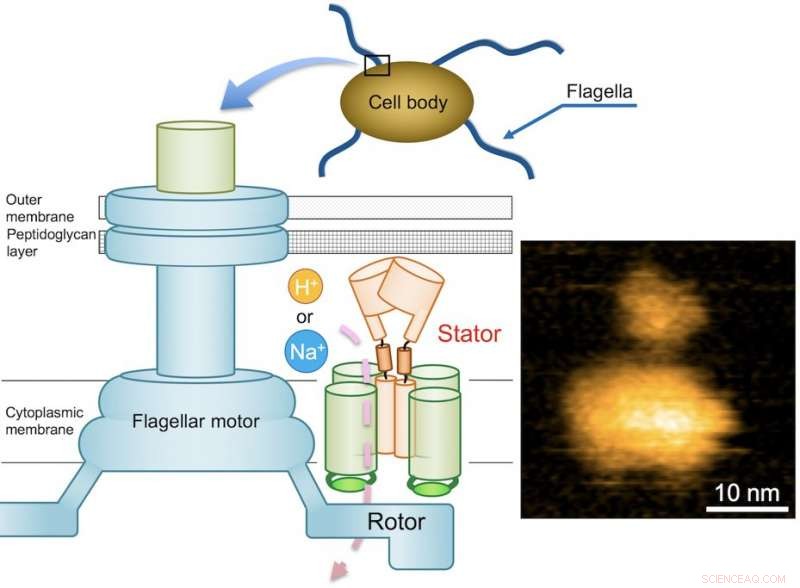
Fig. 1. Schematiskt diagram över den bakteriella flagellära motorn och en typisk AFM -bild av renat MotPS -komplex. Upphovsman:Osaka University
Bakterier simmar på många olika sätt, och motorerna som driver deras simning är mycket varierande, vilket innebär ett adaptivt svar på en miljö. En av de vanligast identifierade av sådana motorer är flagella. Även om rörlighet är ett primärt inslag i flagellan, lim och andra egenskaper har också tillskrivits dem.
Flagellmotorn består av en rotor och ett dussin statorenheter, och drivs av energin som skapas av joner när de migrerar över cellmembranet. Medan flagellmotorn för vissa sötvatten och enteriska bakterier, som Salmonella, drivs av protoner (vätejoner, H + ), som består av fyra kopior av proteinet MotA och två kopior av MotB, motorer av andra bakterier som lever i saltvattenmiljöer drivs av natriumjoner (Na + ).
När det gäller Bacillus subtilis (B. subtilis), en bakterie som vanligen finns i jorden, flagellmotorn har två olika typer av statorenheter:H+-typ MotAB och Na+-typ MotPS. Medan komponenterna identifieras, mekanismen som driver flagellmotorn förblir okänd. Detta mysterium förvärras ytterligare av det faktum att flageller inte syns tydligt under ljusmikroskopet. Dessa utmaningar sätter ett team av forskare i Osaka-universitetet på jakt efter att belysa den okända mekanismen. De rapporterade sina fynd i Vetenskapliga framsteg .
"Exakta analyser av flagellarmotorns strukturella dynamik med hjälp av höghastighets-atomkraftmikroskopi (HS-AFM) i kombination med mutationsanalys gav insikter i flagellmotorns vridmomentgenereringsmekanism, "säger den första författaren till studien Naoya Terahara." Vi gjorde realtidsobservationer av de Na+-inducerade strukturförändringarna på MotS-området som binder peptidoglykan, en polymer bestående av sockerarter och aminosyror i bakterier. "
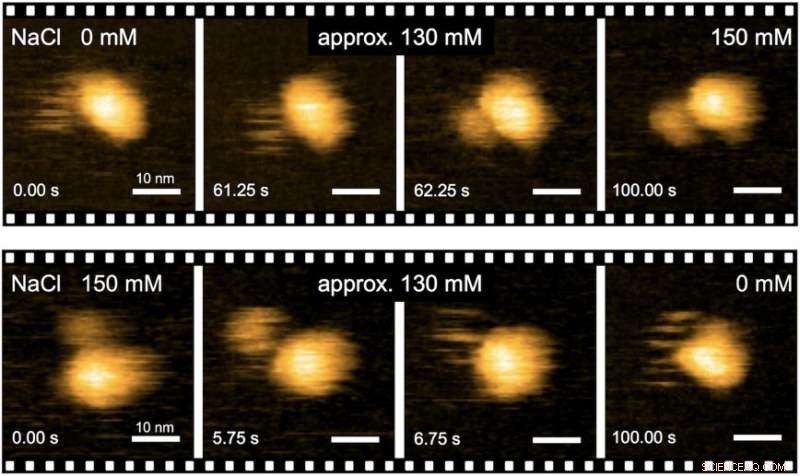
Fig. 2. Realtidsavbildning av Na+-inducerade strukturella övergångar av MotPS-komplexet med HS-AFM. Upphovsman:Osaka University
För att förstå hur MotPS proteinkomplex reagerar på förändringar i miljön, forskarna kännetecknade först förhållandet mellan vridmoment och hastighet för B. subtilis-motorn över ett stort antal Na+ -koncentrationer. Motorns maximala hastighet minskade från cirka 200 till 80 Hz när den externa Na+ -koncentrationen ökades från 0 till 200 mM, även om stallmomentet inte ändrades alls.
I synnerhet, när MotB -domänen som binder till peptidoglykan ersattes av den för MotS, den chimära motorn bibehöll samma vridmoment-hastighetskurva som MotAB-motorn i närvaro av Na+ -joner men inte i frånvaro. Detta innebär att Na+ är huvuddrivrutinen för montering och aktivering av flagellmotor, oavsett dess sammansättning.
"I avsaknad av natriumjoner, MotPS existerar som en inaktiv form i det cytoplasmatiska membranet eftersom MotSc, den C-terminala periplasmatiska domänen för MotS, antar en oviktad konformation. När koncentrationen av natriumjoner ökar, jonernas bindning till MotSc inducerar vikningen av PGB -domänen och underlättar dess dimerisering på ett mycket kooperativt sätt, säger motsvarande författare Tohru Minamino.
Genom denna studie, laget har också visat att det är möjligt att använda HS-AFM kombinerat med mutationsanalys för att studera invecklade bakteriestrukturer, som kan ge värdefull insikt för industriell produktion av kommersiellt livskraftiga produkter, såsom proteaser och terapier, som i fallet med B. subtilis.
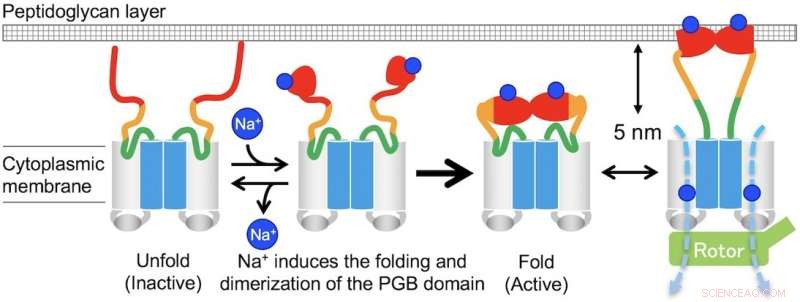
Fig. 3. Modell för Na+-inducerad montering och demontering av MotPS-statorkomplexet. Upphovsman:Osaka University