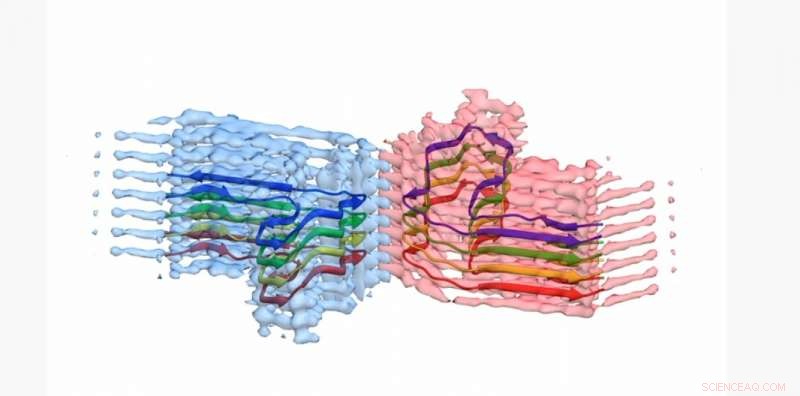
En sektion av en b2m amyloidfibril, med atommodellen för 8 kopior av b2m-proteinet inbyggt i EM-densiteten. Fibrillen är uppbyggd av två "protofilament" som sveper sig runt varandra (blå och rosa). Denna sektion är cirka 4 miljarddelar av en meter lång. Kredit:University of Leeds
Det sekelgamla uppdraget att förstå hur proteinerna ansvarar för amyloidbaserade sjukdomar som Alzheimers, Huntingdons och Parkinsons arbete har tagit stora steg framåt under de senaste 12 månaderna, tack vare en revolution inom en kraftfull mikroskopiteknik som används av forskare.
Kraftfulla mikroskop som använder elektroner istället för ljus för att "se" den faktiska formen på prover som placeras under dem, på nära atomära detaljnivåer, har först nyligen blivit tillgängliga för brittiska forskare.
Storbritannien har investerat mycket i de "spelförändrande" kryoelektronmikroskopen, men det finns fortfarande färre än 25 av instrumenten på flera miljoner pund vid brittiska universitet och forskningsinstitut.
De två instrumenten vid University of Leeds, finansierat av universitetet självt och Wellcome, är de enda i sitt slag i norra England.
De har redan visat sitt värde som ett nyckelverktyg för forskare som har använt dem i ett antal forskningsprojekt, men har precis levererat sin största framgång hittills:att avslöja strukturen hos amyloid – en uppbyggnad av onormala proteiner i kroppen som orsakar sjukdom.
Det finns mindre än 10 bilder av god kvalitet och strukturer av dessa typer av proteiner tillgängliga att studera i världen, så Leeds forskning ger ett betydande bidrag till forskarnas förståelse av hur proteiner bildar aggregat och hur de kan bidra till amyloidsjukdom.
Bilderna och 3D-strukturerna av proteinaggregaten - som Leeds-forskarna visade bildade långa, tvinnade fibrer – har publicerats i tidskriften Naturkommunikation . Proteinet som är involverat - β2-mikroglobulin - är normalt involverat i ett friskt immunsystem, men kan samlas i de smärtorsakande amyloidfibrerna hos personer som genomgår långtidsdialys för njursvikt. När de fastnar i människors leder kan de orsaka artros
Det förväntas att resultaten kommer att användas av läkemedelstillverkare och forskningsgrupper internationellt som strävar efter att finansiera botemedel mot amyloidsjukdomar av alla slag.
Professor Sheena Radford FMedSci, FRS och professor Neil Ranson från universitetets Astbury Center for Structural Molecular Biology, ledde det femåriga programmet för att avbilda proteinfibrerna och visa deras 3D-struktur.
Paret fick stöd av kollegor på Leeds, Josh Boardman, som vid den tiden var en student i biokemi.

Dr Rebecca Thompson, University of Leeds Cryo-Electron Microscopy Center Manager laddar ett prov i ett av mikroskopen. Kredit:University of Leeds
Studien involverade också ett långvarigt samarbete med professor Bob Griffin, från Massachusetts Institute for Technology, som är specialiserad på en annan metod för avancerad biologisk analys av biologiskt material - kärnmagnetisk resonans i fast tillstånd.
Professor Radford sa:"Under de senaste sex decennierna sedan de första elektronmikroskopbilderna av amyloid skapades, forskare har gått från att arbeta med suddiga lågupplösta bilder till våra knivskarpa 3D-bilder och strukturer, tack vare moderna framsteg inom kryoelektronmikroskopi.
"Nu vet vi exakt var varje kink och punkt är på proteinet, vi kanske kan utveckla föreningar som låser tätt till den, eller störa det, och ta reda på hur fibrerna bidrar till sjukdomar. Det motsvarar att gå från att försöka få två ballonger att hålla ihop till att ha två kuggar som roterar perfekt med varandra.
Hon tillade:"Vi har använt kryo-elektronmikroskopi inte bara för att avslöja formen och strukturen hos amyloidproteiner, men också hur de växer och flätas samman med varandra som stativen i ett rep för att bilda större sammansättningar. Denna kunskap kommer att vara avgörande för att veta hur man ska hantera dem."
Professor Ranson sa:"Fram till för något år sedan, forskare visste att strukturen såg ut mer eller mindre som en stege, men vi har nu visat att det är mycket mer komplext än så. Vi börjar nu se hur olika proteiner viks ihop till olika former och hur de varierar med varje sjukdom de orsakar.
"Den extra detalj vi har avslöjat betyder att vi kan börja förstå dessa proteiners sjukdomsframkallande förmågor.
Han tillade "Amyloidfibrer är också kända för att ha styrkan av stål, och, nu förstår vi deras strukturer. Vi kanske kan göra nya biomaterial inspirerade av deras strukturer. Detta är ett bra exempel på var kryo-elektronmikroskopi kan ha ytterligare fördelar."
Att känna till proteinets struktur i detaljnivån som Leeds-forskarna har tillhandahållit, och mäta dessa skillnader i olika typer av amyloidsjukdomar och olika patienter, kan också tillåta läkare att visa vem som är mest utsatt, vilket innebär att behandlingen kan riktas till dem som behöver det mest.
Nästa steg för forskarvärlden är att börja identifiera och utveckla inhibitorer - föreningar som kan kontrollera proteinsammansättningen till amyloid. Professor Radford har säkrat nästan 2 miljoner pund från Wellcome för att genomföra detta utvecklingsstadium.
Ytterligare laboratorieförsök, kliniska tester, regulatoriskt godkännande och involvering av en läkemedelsutvecklare skulle fortfarande krävas innan läkemedel kunde släppas ut på marknaden, men de betydande stegen framåt i bildens klarhet och förståelse av amyloidvikningsstrukturen markerar ett stort steg framåt.
Hela forskningsartikeln Strukturen hos en β2-mikroglobulinfibril tyder på en molekylär grund för dess amyloidpolymorfism publiceras i Naturkommunikation .