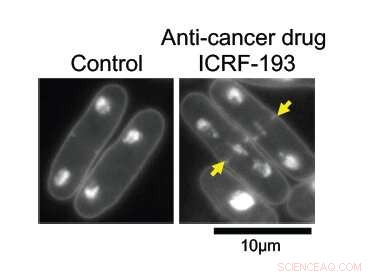
Med DNA-topoisomeras II (topo II) intakt, DNA i fissionsjästceller replikerar normalt och delas jämnt mellan två dotterceller (vänster). När under effekterna av anti-cancerläkemedlet ICRF-193, DNA trasslar ihop sig i mitten av modercellen, förhindra dess rena uppdelning. Kredit:Okinawa Institute of Science and Technology Graduate University
Ungefär som skosnören eller hängande halsband, DNA-strängar kan trassla ihop sig i oregerliga knutar. Specialiserade enzymer håller DNA organiserat när celler delar sig, så att cellerna delar sig smidigt och inte fastnar. Men i tumörceller, detta felsäkra tillåter cancer att spridas. Nu, forskare vid Okinawa Institute of Science and Technology Graduate University (OIST) har lärt sig hur denna mekanism fungerar i fissionsjäst och hur den kan undermineras vid cancer hos människor.
Studien, publicerades online den 11 januari, 2019 av Journal of Biological Chemistry , fokuserar på ett väletablerat mål för cancerterapi:DNA topoisomeras II, eller topo II för kort. Topo II reglerar topologin av DNA, hantera den föränderliga strukturen av trådarna över tiden. Cancerceller visar ökad topo II-aktivitet, vilket i sin tur stimulerar tumörtillväxt. Topo II anticancerläkemedel undertrycker enzymets funktion, förhindra tumörceller från att replikera och hindra cancers spridning.
Men befintliga topo II-läkemedel har visat begränsad framgång - forskare behöver veta mer om den grundläggande mekanismen innan de kan trubba den effektivt.
"Många forskare arbetar med topo II, men de använder huvudsakligen mänskliga eller högre eukaryota celler, " sa Dr Norihiko Nakazawa, första författare till studien och en stabsforskare vid OIST G0 Cell Unit, ledd av Prof. Mitsuhiro Yanagida. Enheten valde att studera topo II i fissionsjäst eftersom dess celldelningsmekanismer till stor del är bevarade hos människor, han sa, förutom att vara snabb och enkel att manipulera.
DNA topoisomeras II (topo II), en mästare regulator av DNA-metabolism för cellproliferation, är ett kritiskt mål för anti-cancerterapi. Kredit:Okinawa Institute of Science and Technology Graduate University
"Vi kan snabbt fånga topo II-reaktionen i jäst, fortsätt sedan för att studera det i mänskliga celler, ", sa Nakazawa. "Vårt arbete visar att jäst är en bra modell för att screena topo II-läkemedel och skulle vara en snabb metod att använda i kliniska tillämpningar."
Öka effektiviteten av läkemedel mot cancer
Forskarna hade som mål att lära sig hur topo II fungerar på molekylär nivå. Vid högre förstoringar, dess effekter är uppenbara; celler med det intakta enzymet delar sig normalt, med hälften av sitt replikerade genetiska material på varje sida av klyftan. Utan topo II, DNA förblir trassligt i mitten av modercellen, förhindrar dess korrekta uppdelning i två dotterceller.
Tidigare forskning tyder på att topo II förlitar sig på fosforylering - tillägget av en fosfatgrupp på exakta platser i dess struktur. I fissionsjäst och mänskliga celler, enzymet kasein kinas II, även känd som CKII, steg in för att fosforylera specifika regioner av topo II. I det här arbetet, Nakazawa identifierade dessa regioner och fann att några förblev fosforylerade under hela cellcykeln. Detta konstanta kemiska utbyte ökade aktiviteten i en region av topo II känd som "ATPas-domänen". Även om forskarna observerade förbättringen, i början, de kunde inte berätta hur det faktiskt förändrade topo II-funktionen.
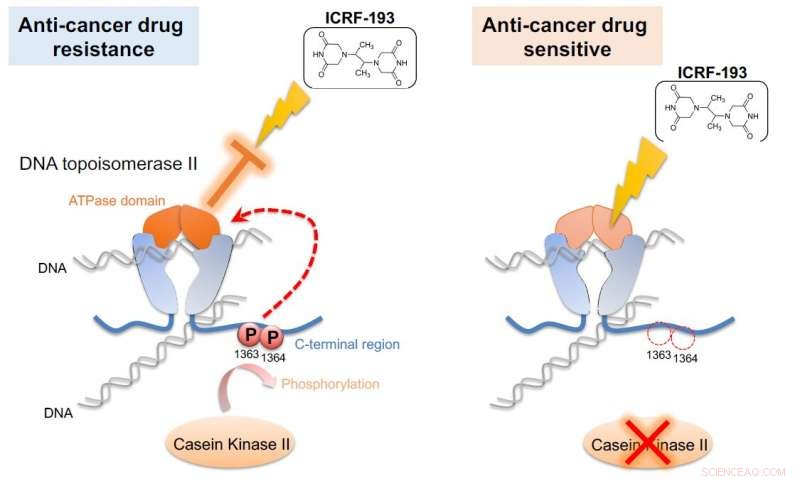
Kaseinkinas II (CKII) fosforylerar DNA-topoisomeras II (topo II), aktiverar således ATPas-domänen av enzymet (vänster). Denna aktivering upphäver effekterna av anticancerläkemedlet ICRF-193. Om CKII-aktiviteten är dämpad (höger), effektiviteten av ICRF-193 är räddad. G0-cellenheten visade denna mekanism i fissionsjäst, en enkel modell som skulle kunna användas för screening av läkemedel mot cancer. Kredit:Okinawa Institute of Science and Technology Graduate University
Forskarna löste pusslet genom att kasta ett topo II-läkemedel i mixen. Läkemedlet ICRF-193 verkar genom att hämma ATPas-aktiviteten hos topo II, som effektivt fångar DNA i en tät konfiguration så att den inte kan utföra enzymatiska reaktioner. Men i närvaro av CKII, som ökar ATPas-aktiviteten, läkemedlet görs ineffektivt.
"Denna [ATPas-domän] förbättring bröt anticancerläkemedlets effekt, " sa Nakazawa. "Om vi blockerar fosforyleringen, denna aktivering sker inte och läkemedlet förblir effektivt."
Potentiell grund för nya terapier
Bevis tyder på att topo II och CKII interagerar i mänskliga celler precis som de gör i fissionsjäst. Cancerceller uttrycker högre nivåer av både topo II och CKII än normala vävnader, och båda enzymerna har associerats med onormal cellproliferation. Nu när forskare förstår den underliggande mekanismen i jäst, de kan tillämpa den kunskapen i framtida studier av mänskliga cancerceller. Någon dag, forskningen kan leda till nya cancerbehandlingar.
"Om vi hämmar CKII och topo II, det kan vara ett mycket effektivt sätt att hämma cancercelldelning, " sade Nakazawa. "Denna additiv effekt kan vara mycket kraftfull i cancerterapi."