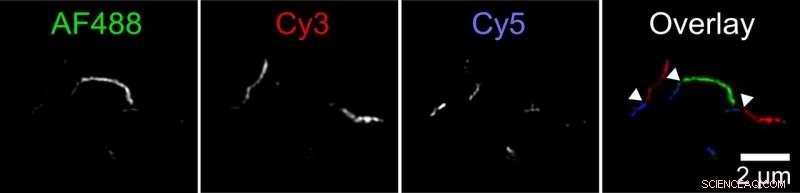
Biofysiker har upptäckt en ny mekanism genom vilken aggregat av tau-protein, kallas fibriller, kan växa. Två fibriller kan fästa ände till ände. Denna figur visar en fibrill som består av mindre fibriller märkta i tre färger. Forskaren märkte tau-proteiner med tre olika fluorescerande färgämnen och tillät dem att aggregera i separata provrör. Sedan blandade hon ihop dessa olikfärgade fibriller i ett fjärde provrör. Bilder tagna med ett superupplöst fluorescensmikroskop visade långa fibriller med korta sektioner av varje färg, vilket indikerar att fibriller från originalprovrör måste ha sammanfogade ändar för att bilda längre fibriller. Kredit:Carol Huseby/Ohio State University
Tidigt under Alzheimers sjukdom – långt innan framtida patienter börjar märka symtom – börjar neurofibrillära tovor som består av tau-proteinaggregat att bildas i deras hjärnceller. Hur giftiga dessa aggregat är och hur väl de sprids beror på deras storlek. Dock, forskare som studerar trasselbildning har inte kunnat förklara varför olika storlekar av kabelliknande tau-aggregat uppstår vid sjukdom.
Men nu, forskare vid Ohio State University har upptäckt att istället för att bara lägga till ett protein åt gången, fibriller av olika längd kan sammanfogas ände till ände för att skapa en längre filament. Fyndet, som kommer att visas i Journal of Biological Chemistry på måndag, hjälper till att förklara hur fibriller kan växa till hundratals nanometer och kan också hjälpa forskare att förstå mekanismerna hos en framväxande grupp av läkemedelskandidater utformade för att hämma tau-aggregation.
Forskare kan använda matematiska modeller för att beskriva biologiska processer som fibrillerbildning. En vanlig enkel modell för tau-aggregation inkluderar två steg. I det första steget, två tau-proteiner binder långsamt, och, i det andra steget, ytterligare tau-molekyler låser sig snabbt.
Första författaren Carol Huseby, en doktorand i Jeff Kurets labb, arbetar i samarbete med Ralf Bundschuh, försökte utöka denna matematiska modell till att inkludera andra kända sätt som tau-fibriller beter sig på. Forskare har observerat, till exempel, att ibland en fibril splittras i två. Andra tider, en ny fibril kan bilda kärnor i mitten av en befintlig fibril.
Den enkla tvåstegsmodellen förutspådde att ett provrör fyllt med renat tau-protein skulle resultera i ett stort antal korta fibriller. Men Huseby visste att när forskare tittar på aggregerat tau-protein under ett mikroskop, de ser ett mindre antal långa fibriller. Den diskrepansen antydde att något hände i den verkliga världen som inte hade tagits med i modellen. De antog att kanske korta fibriller kunde fästa från ände till ände för att bli längre.
Huseby körde en serie experiment för att testa hypotesen. I ett, först märkte hon tau-proteiner med tre olika fluorescerande färger och lät dem samlas i separata provrör. Sedan blandade hon ihop dessa olikfärgade fibriller i ett fjärde provrör.
Bilder tagna med ett superupplöst fluorescensmikroskop visade långa fibriller med korta sektioner av varje färg, vilket indikerar att fibriller från originalprovrör måste ha sammanfogade ändar för att bilda längre fibriller. Kontrollexperiment visade att detta inte kan förklaras av märkta molekylers preferens för liknande märkningar.
Efter att Huseby införlivat denna nya mekanism i modellen, det gav en mycket bättre beskrivning av vad renade tau-proteiner verkligen gjorde när de bildade aggregat. Denna studie är den första som visar att fibrillerna kan förlängas med mer än ett tau-protein åt gången.
Alzheimers forskare försöker fortfarande urskilja om tau-fibriller är en orsak eller bara en effekt av sjukdomen. En möjlighet är att överföring av fibriller från en cell till en annan kan bidra till att sjukdomar sprids i hjärnan. En mycket lång fibrill, enligt Kuret, är osannolikt att sprida sig på detta sätt. "Men när den väl har brutits upp i små bitar, de kan sprida sig, underlättar deras förflyttning från cell till cell."
Denna studie använde bara en typ av tau. Sex isoformer av olika längd är kända, och fosforylering och andra förändringar ökar proteinets komplexitet. Forskarna planerar att införliva dessa variabler i framtida arbete, och att börja använda modellen för att förstå hur tau-hämmare förändrar proteinaggregatens beteende.