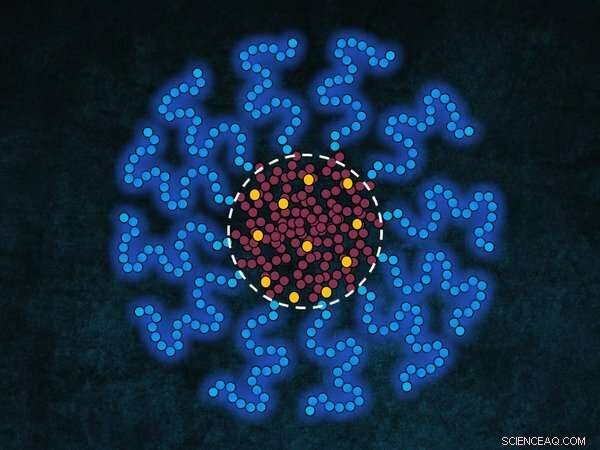
Schematisk figur av en micell – som består av ett hydrofilt skal (blå svansar) och en hydrofob kärna (röda svansar) – som kapslar in läkemedelsmolekyler (gul). Läkemedelsmolekylerna samlas för det mesta vid gränsytan mellan kärna och skal (streckad vit linje) av micellen om koncentrationen av läkemedlet är under lösningsmedlets vattenlöslighet, medan om koncentrationen är över lösligheten samlas de i kärnan. Kredit:Alessandro Ianori
Forskare vid Eindhoven University of Technology och Utrecht University har upptäckt parametrarna som styr inkapslingen av läkemedel. Detta ger mer kontroll över den långsamma och stadiga frisättningen av läkemedel hos patienter. Dessutom, att designa inkapslingar för nya läkemedel kommer nu att kräva mycket mindre experiment, vilket ger snabbare och billigare läkemedelsutveckling. Forskarna tror att detta arbete kommer att ha en betydande inverkan på det biomedicinska området och utformningen av framtida läkemedel.
Många läkemedel är hydrofoba - de löser sig inte bra i vatten - vilket gör läkemedelsleveransen problematisk till patienter. En möjlig lösning är att kapsla in läkemedlen i små förpackningar som är hydrofoba (vattenavvisande) på insidan och hydrofila (vattenlösliga) på utsidan. Läkemedlen kommer att ackumuleras i insidan av dessa förpackningar och transporten av läkemedlet genom patientens kropp blir mycket lättare. Förpackningarna består ofta av associerade ytaktiva ämnen, som är läkemedelsgodkända. När det är löst i vatten, en fysiologisk lösning, eller blod, dessa molekyler orienterar sin hydrofoba del mot den inre kärnan (med affinitet för de olösliga läkemedlen) och deras hydrofila sida mot utsidan, bildar ett sfäriskt "paket", kallas en micell.
Var i en micell
Att transportera droger i hela kroppen på detta sätt har varit möjligt i årtionden, men först nu förstår forskare vilka faktorer som exakt dikterar var läkemedlen inuti micellen samlas. Denna rumsliga fördelning kan dramatiskt påverka frisättningshastigheten av läkemedlen inuti en patient. Vissa läkemedel koncentreras till mitten av den hydrofoba kärnan av micellen och frigörs långsamt, vilket är önskvärt för en patients läkemedelsupptag. Andra läkemedel samlas vid gränssnittet mellan kärna och skal av micellen och frigörs vanligtvis snabbt. Därför, kontroll av läkemedlens placering i micellinkapslingen styr frisättningshastigheten för läkemedlen.
Använder ett färgämne för att spåra droger
För att undersöka var olösliga droger samlas, forskarna använde Nile Red, en färgämnesmolekyl som liknar storleken och lösligheten hos typiska läkemedel. Färgämnet har en mycket smart egenskap:det absorberar inte bara en specifik ljusfärg, men också den färgen beror på dess miljö. Om färgämnet är löst i rent vatten, det absorberar ljus av en annan färg än om det också finns lite alkohol löst i vattnet. Att ändra förhållandet vatten/alkohol är ett smart sätt att simulera ett bra lösningsmedel eller ett dåligt lösningsmedel för färgämnet. Detta är analogt med att arbeta med ett vattenlösligt läkemedel eller ett olösligt läkemedel. Genom att mäta ljusabsorptionen, forskarna kunde avgöra hur mycket färgämne som samlades i kärnan av micellen och hur mycket vid gränssnittet mellan kärna och skal.
Experiment kombinerat med datorsimuleringar
För att bekräfta deras fynd, forskarna gjorde datorsimuleringar för att bestämma placeringen av de upplösta läkemedlen och formen på blocksampolymermicellen. Beräkningarna avslöjar arrangemanget av komponenterna inuti och utanför micellen, gör det möjligt att bedöma de föredragna regionerna av läkemedlet.
Från experimenten och beräkningarna drogs slutsatsen att den föredragna regionen av läkemedlet inuti segmentsampolymermicellerna mestadels bestäms av koncentrationen och lösligheten av läkemedelsmolekylerna i det omgivande mediet (vatten/fysiologiskt medium/blod). Om koncentrationen av läkemedlet är under lösningsmedlets vattenlöslighet samlas läkemedelsmolekylerna vid gränsytan mellan kärna och skal i micellen, medan om koncentrationen är över lösligheten samlas de i kärnan.
Färre försök-och-fel-experiment
Dagens forskning om läkemedelsinkapsling domineras av försök och misstag. Resultaten som redovisas i denna studie möjliggör enklare och billigare utveckling av smarta läkemedel. Detta kommer att bidra till att minska biverkningar i samband med terapi och underlätta skapandet av personliga terapeutiska behandlingar där frisättningen av läkemedlet anpassas till patientens individuella behov.