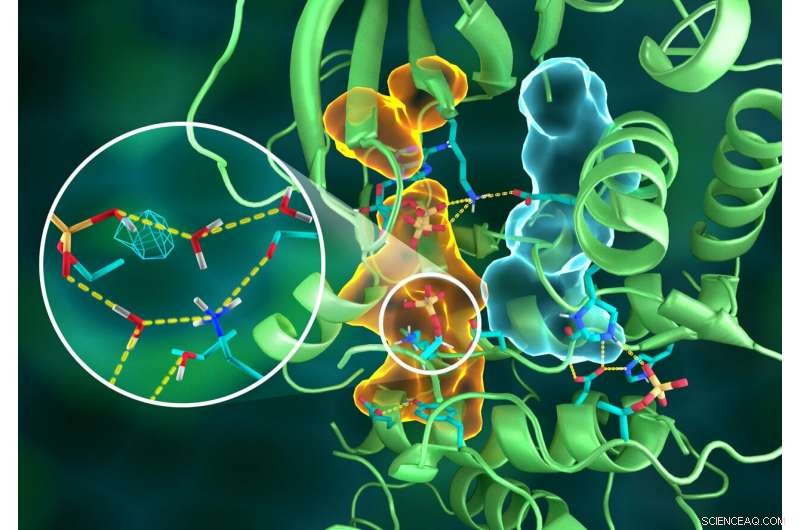
Illustration av den invecklade organisationen av PKA-strukturen, varvid olika delar av proteinet är sammankopplade genom utarbetade vätebindningsnätverk (streckade gula linjer), limmas ihop av de hydrofoba enheterna (ljusblå och orange volymer) -- alla arbetar tillsammans för att bygga den funktionella aktiva platsen. Infogningen visar protonering av den överförda fosforylgruppen (cyannät) och dess många interaktioner med vatten och aminosyraresterna på det aktiva stället. Kredit:ORNL/Jill Hemman
Direkta observationer av strukturen och den katalytiska mekanismen hos ett prototypiskt kinasenzym – proteinkinas A eller PKA – kommer att ge forskare och läkemedelsutvecklare avsevärt förbättrade förmågor att förstå och behandla dödliga sjukdomar och neurologiska störningar som cancer, diabetes, och cystisk fibros.
Upptäckten gjordes av ett internationellt team av forskare som använder makromolekylär neutronkristallografi vid Department of Energy's Oak Ridge National Laboratory och Institut Laue-Langevin i Grenoble, Frankrike. Bygger på en decennielång utredning, de kombinerade ansträngningarna avslöjade tidigare okända egenskaper hos det arketypiska proteinkinaset, inklusive en komplett karta över atomstrukturen och grunderna för enzymets kemi som används i cellulär signalering. Detaljerna publiceras i tidskriften Vetenskapens framsteg .
Kinaser är en stor grupp av hundratals enzymer som är ansvariga för att initiera och reglera otaliga cellulära processer. Kinaser skickar signaler till proteiner genom fosforylering - tillsätter en reaktiv kemisk grupp bestående av fosfor och syre till en specifik plats på ett substratprotein för att aktivera dess specifika biologiska funktion.
Problem uppstår när genmutationer får kinaser att fungera felaktigt, vilket i sin tur leder till sjukdom. Ett felaktigt kinas, eller en som inte kan avaktiveras, kan vara ansvarigt för överuttrycket av proteiner som leder till okontrollerbar förökning av cancerceller. Motsatsen är också sant vid neurologiska störningar där ett felaktigt kinas helt enkelt får celler att dö.
"Att skapa läkemedel som riktar sig mot specifika kinaser är extremt viktigt, " sa medförfattaren Andrey Kovalevsky. "Denna detaljerade förståelse av PKA-strukturen och dess dynamik kommer att berätta mer om andra typer av kinaser och bör hjälpa läkemedelsutvecklare att designa nya läkemedel med bättre specificitet, vilket i slutändan skulle översättas till mer exakt terapi med färre biverkningar."
Förändringar i proteinstrukturen på grund av mutationer kan vara svåra att upptäcka även om effekterna av mutationer på proteinets dynamiska beteende kan vara ganska djupgående. Dock, dessa dynamiska beteenden blir mer uppenbara genom att undersöka det övergripande vätebindningsnätverket genom hela proteinet.
Neutroner är unikt känsliga för lätta element som väte. Eftersom ungefär 50 procent av alla atomer i proteiner är väte, och de flesta av de kemiska reaktioner som enzymer katalyserar involverar väte, neutroner är en idealisk och oöverträffad sond för att detektera positionerna för väteatomer i proteinstrukturen och spåra deras rörelse under katalys.
Neutrondiffraktion med hjälp av IMAGINE-diffraktometern vid ORNLs högflödesisotopreaktor, en användaranläggning för DOE Office of Science, och LADI-III diffraktometern vid ILL gjorde det möjligt för forskare att se de exakta positionerna för väteatomer för att avslöja den fullständiga kinasstrukturen såväl som protonationstillstånden för alla aminosyror i PKA och liganderna bundna till dess aktiva plats, varav många tidigare var okända.
"Neutroner gjorde det möjligt för oss att validera röntgenförutsägelser om väteatomers positioner, samt bestämma protonationstillstånden för kemiska grupper som inte var kända, eller på platser där vi inte förväntade oss att hitta dem. Detta stora kemiska framsteg banar väg för mer sofistikerade molekylära modellerings- och simuleringsstudier av proteinkinasstruktur och funktion, " sa motsvarande författare Susan Taylor.
"Neutroner erbjuder en aldrig tidigare skådad bild av vätebindningsnätverket som omger och inom den aktiva platsen för PKA och ger avgörande insikter om hur allosterisk överföring av information genom proteinstrukturen sker, ", tillade medförfattare Gianluigi Veglia. "Att kombinera neutronkristallografi med kärnmagnetisk resonansspektroskopi kommer att ge en heltäckande förståelse för hur enzymer fungerar."