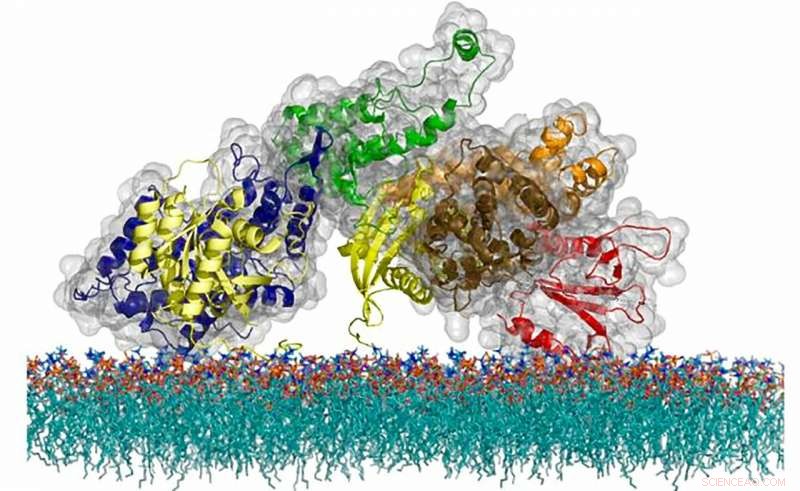
Atomstrukturen av SOS-proteinet, en cellmeddelandemolekyl som använder en unik timingmekanism för att reglera aktiveringen av ett kritiskt immunsystem. Kredit:Steven Alvarez/Berkeley Lab
För första gången någonsin, forskare har avbildat processen genom vilken en enskild immunsystemmolekyl slås på som svar på en signal från omgivningen, leder till den kritiska upptäckten att aktiveringsprocessen involverar hundratals proteiner som plötsligt samlas för att bilda ett länkat nätverk genom en process som kallas en fasövergång.
Det nya verket, beskrivs i en tidning som nyligen publicerats i Vetenskap , ger ett enormt steg framåt i vår förståelse av hur immunsystemet är finjusterat för att upptäcka även en enda virusmolekyl mitt i ett hav av miljontals andra molekyler, vilket gör att vi snabbt kan återhämta oss från virusinfektioner som influensa. Genom att lära sig hur just dessa proteiner fungerar, forskare kommer också att ha bättre koll på varför deras aktivitet ibland går snett – händelser som kan leda till autoimmuna sjukdomar, såsom diabetes eller reumatoid artrit – och kan ge unika insikter om hur man styr en cancerpatients eget immunsystem att bota cancer.
"Detta är något som händer inuti en levande cell under processen att cellen fattar ett beslut - signaltransduktion är vad vi kallar det - och det är hur celler "tänker" med kemiska reaktioner, " sa studieledaren Jay Groves, en fakultetskemist inom biovetenskapsområdet vid Department of Energys Lawrence Berkeley National Laboratory (Berkeley Lab). "Inom biologin som helhet, Idén om en proteinkondensationsfasövergång har fått mycket uppmärksamhet nyligen. Många grupper över hela världen studerar dessa fenomen, men tills nu, ingen visste hur eller varför cellen använder dem.
"Vår tidning är, Jag tror, den första att direkt testa och bekräfta hur en fasövergång kan reglera signalering, " Sa Groves. "Och den stora upptäckten är att det är en molekylär tidsmekanism. Cellen använder tid för att skilja en äkta receptorstimulering från kemiskt bakgrundsljud."
Studerar en viktig cellbudbärare
Teamets avslöjande kom till som en del av den pågående forskningen av Groves lab om de fysiska mekanismerna för T-cellssignalering och Ras-proteinet. Finns i alla eukaryota celler i flera varianter, Ras bär många hattar, inklusive fungera som en regulator för celltillväxt, division, och döden. T-celler, immunsystemets celler som upptäcker främmande och potentiellt skadliga infektioner, använd Ras som en på/av-brytare för larmvägen för inkräktare som startar ett skyddande svar. T-cellens förmåga att särskilja en verklig yttre signal – när en främmande molekyl binder till den passande namngivna T-cellsreceptorn (TCR) på cellytan – från oavsiktlig kontakt med närliggande proteiner är avgörande för ett fungerande immunsystem. Om en T-cell av misstag reagerar på en av våra egna molekyler, då kan en autoimmun sjukdom utvecklas. På samma gång, om en T-cell förlorar sin känslighet, då kommer virus att kunna växa okontrollerat och cancerceller rensas inte bort från kroppen.
På grund av de omfattande konsekvenserna för människors hälsa, forskare har länge undrat hur cellerna reglerar sina signaler för att uppnå denna balans. Tidigare forskning hade visat att en T-cells Ras-proteiner inte interagerar direkt med cellreceptorer. Istället, receptorer skickar "på"-signalen till interna intermediära proteiner, inklusive en nyckelgrupp av tre proteiner, känd som LAT, Grb2, och SOS, som slutligen skickar signalen till Ras. Före denna studie, forskare visste att denna molekylära trio kunde länka samman i en fasövergångsprocess, men ingen visste vad fasövergången gjorde. Och tills nyligen, det var omöjligt att förstå, eftersom det inte fanns någon teknologi som gjorde det möjligt för forskare att direkt övervaka aktiviteten från enskilda molekyler i komplexa cellmembransystem.
Forskargruppen tog bort detta hinder genom att uppfinna ett tillvägagångssätt baserat på stödda membranmikroarrayer, en teknik som teamet har utvecklat i många år som använder ställningar gjorda av nanotillverkade strukturer för att hålla cellmembran.
Fasövergångar på jobbet
I den aktuella studien, forskarna använde mikroskopi för att se ögonblicket då en T-cellsreceptor på en understödd membranmikroarray bad en enda SOS-molekyl att aktiveras. Istället för att svara direkt, SOS väntade i 10 till 30 sekunder innan det övergick till sitt aktiva tillstånd. Om de närliggande LAT- och Grb2-molekylerna genomgick fasövergången med SOS, och kondenseras till sitt sammansatta tillstånd, de kunde hålla SOS på membranet tillräckligt länge för att SOS skulle aktiveras. Utan fasövergången, den långa fördröjningen i SOS-molekylen skulle hindra den från att aktiveras innan den lämnade receptorn.
"Det är som att proteinet har en fördröjning inbyggd, " förklarade Groves. "Den behöver fasövergången kombinerad med ihållande signalering, och först då kommer den att slås på."
Även om denna forskning var specifik för T-cellssignalering, Groves och hans kollegor tror att liknande fasövergångstidsmekanismer sannolikt är involverade i en mängd andra cellsvar. Nu när de etablerade en beprövad experimentell teknik för att observera den molekylära aktiveringen av sådana processer, teamet hoppas kunna reda ut fler långvariga mysterier om hur celler utför så många komplexa uppgifter.