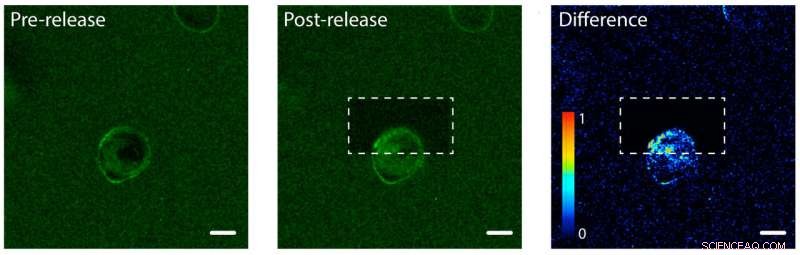
Fotofrisättning av proteiner från epidermal tillväxtfaktor (EGF) på ena sidan av en mänsklig cell. Vänster:EGF (grön) är bunden till en hydrogel en enda mänsklig cell (mitten). Cellmembranet binder EGF, gör dess membran grönt. Mitten:Hydrogelen efter att ha använt en laser för att lossa och frigöra EGF-proteiner på den övre delen av cellen. Till höger:En bild som visar skillnaden i grönt fluorescerande färg mellan bilder efter och före utgivningen. Notera ökningen i färg i den övre delen av cellen, vilket indikerar att cellen har börjat internalisera de obundna EGF-proteinerna men bara på ena sidan. Skalstången är 10 mikrometer. Kredit:Shadish, Benuska och DeForest, 2019, Naturmaterial
Vävnadsteknik kan förändra medicin. Istället för att vänta på att våra kroppar ska växa igen eller reparera skador efter en skada eller sjukdom, forskare kan bli komplexa, fullt fungerande vävnader i ett laboratorium för transplantation till patienter.
Proteiner är nyckeln till denna framtid. I våra kroppar, proteinsignaler talar om för cellerna vart de ska gå, när man ska dela och vad man ska göra. I labbet, forskare använder proteiner för samma syfte - att placera proteiner på specifika ställen på eller inom konstruerade ställningar, och sedan använda dessa proteinsignaler för att kontrollera cellmigration, division och differentiering.
Men proteiner i dessa miljöer är också ömtåliga. För att få dem att fastna på ställningarna, forskare har traditionellt modifierat proteiner med hjälp av kemi som dödar mer än 90 procent av deras funktion. I en artikel publicerad 20 maj i tidskriften Naturmaterial , ett team av forskare från University of Washington presenterade en ny strategi för att hålla proteiner intakta och funktionella genom att modifiera dem vid en specifik punkt så att de kan fästas kemiskt till ställningen med hjälp av ljus. Eftersom tjudet också kan skäras av med laserljus, denna metod kan skapa mönster av signalproteiner som utvecklas i en biomaterialställning för att växa vävnader som består av olika typer av celler.
"Proteiner är de ultimata förmedlarna av biologisk information, " sa motsvarande författare Cole DeForest, en UW biträdande professor i kemiteknik och bioteknik, samt en affiliate utredare med UW Institute for Stem Cell &Regenerative Medicine. "De driver praktiskt taget alla förändringar i cellfunktion - differentiering, rörelse, tillväxt, död."
Av den anledningen, forskare har länge använt proteiner för att kontrollera celltillväxt och differentiering i vävnadsteknik.
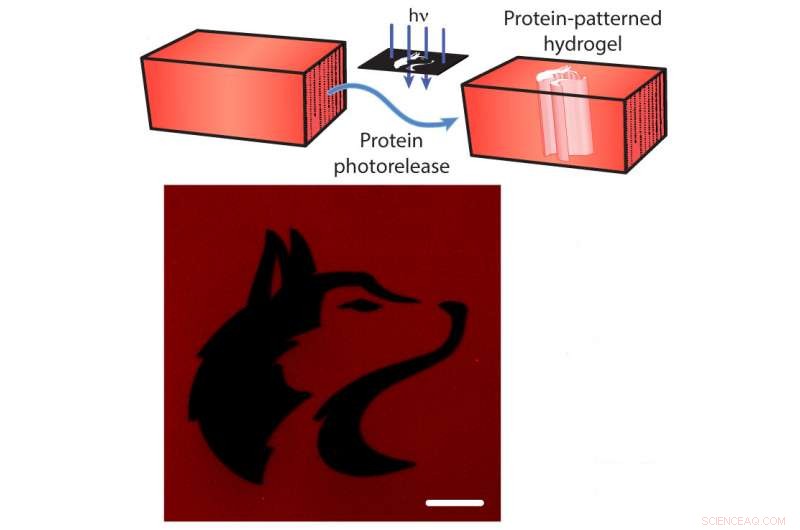
Fotofrisättning av proteiner från en hydrogel. Överst:De mCherry-röda fluorescerande proteinerna är bundna till hydrogelen. Forskare kan klyva tjudet med riktat ljus (blå pilar), frigör mCherry från hydrogelen (blå pilar). Nederst:En bild av hydrogelen efter mCherry-släpp mönstrad i form av University of Washington-maskot (svart). Skalstången är 100 mikrometer. Kredit:Shadish, Benuska och DeForest, 2019, Naturmaterial.
"Men den kemi som oftast används av samhället för att binda proteiner till material, inklusive ställningar för vävnadsteknik, förstöra den överväldigande majoriteten av deras funktion, sa DeForest, som också är fakultetsmedlem i UW Molecular &Engineering Sciences Institute. "Historiskt sett, Forskare har försökt kompensera för detta genom att helt enkelt överbelasta byggnadsställningen med proteiner, att veta att de flesta av dem kommer att vara inaktiva. Här, vi har kommit på ett generaliserbart sätt att funktionalisera biomaterial reversibelt med proteiner samtidigt som de bevarar deras fulla aktivitet."
Deras tillvägagångssätt använder ett enzym som kallas sortas, som finns i många bakterier, att lägga till en kort syntetisk peptid till varje signalprotein på en specifik plats:C-terminalen, en webbplats som finns på varje protein. Teamet designar den peptiden så att den kommer att binda signalproteinet till specifika platser i en vätskefylld biomaterialställning som är vanlig inom vävnadsteknik, känd som en hydrogel.
Att rikta in sig på en enda plats på signalproteinet är det som skiljer UW-teamets tillvägagångssätt. Andra metoder modifierar signalproteiner genom att fästa kemiska grupper till slumpmässiga platser, vilket ofta stör proteinets funktion. Att bara modifiera proteinets C-terminal är mycket mindre sannolikt att störa dess funktion, enligt DeForest. Teamet testade metoden på mer än ett halvdussin olika typer av proteiner. Resultaten visar att modifiering av C-terminalen inte har någon signifikant effekt på proteinfunktionen, och binder framgångsrikt proteinerna genom hydrogelen.
Deras tillvägagångssätt är analogt med att hänga ett inramat konstverk på en vägg. Istället för att slå spikar slumpmässigt genom glaset, duk och ram, de drar en enda tråd över baksidan av varje ram för att hänga den på väggen.
Dessutom, tjudren kan skäras av genom exponering för fokuserat laserljus, orsakar "fotofrisättning" av proteinerna. Genom att använda denna vetenskapliga ljussabel kan forskarna ladda en hydrogel med många olika typer av proteinsignaler, och exponera sedan hydrogelen för laserljus för att ta bort proteiner från vissa delar av hydrogelen. Genom att selektivt exponera endast delar av materialet för laserljus, teamet kontrollerade var proteinsignaler skulle förbli bundna till hydrogelen.

Från vänster till höger:Cole DeForest, Gabrielle Benuska, Jared Shadish. Kredit:Dennis Wise/University of Washington
Att lossa proteiner är användbart i hydrogeler eftersom celler då kan ta upp dessa signaler, föra dem in i cellens inre där de kan påverka processer som genuttryck.
DeForests team testade fotofrisättningsprocessen med en hydrogel laddad med epidermal tillväxtfaktor, en typ av proteinsignal. De introducerade en mänsklig cellinje i hydrogelen och observerade tillväxtfaktorerna som binder till cellmembranen. Teamet använde en laserstråle för att koppla bort proteinsignalerna på ena sidan av en enskild cell, men inte andra sidan. På den bundna sidan av cellen, proteinerna stannade på utsidan av cellen eftersom de fortfarande var fast vid hydrogelen. På den obundna sidan, proteinsignalerna internaliserades av cellen.
"Baserat på hur vi riktar in laserljuset, vi kan säkerställa att olika celler – eller till och med olika delar av enstaka celler – tar emot olika miljösignaler, sa DeForest.
Denna unika precisionsnivå inom en enda cell hjälper inte bara till med vävnadsteknik, men med grundforskning inom cellbiologi, lade till DeForest. Forskare kan använda den här plattformen för att studera hur levande celler svarar på flera kombinationer av proteinsignaler, till exempel. Denna forskningslinje skulle hjälpa forskare att förstå hur proteinsignaler samverkar för att kontrollera celldifferentiering, läka sjuk vävnad och främja mänsklig utveckling.
"Denna plattform tillåter oss att exakt kontrollera när och var bioaktiva proteinsignaler presenteras för celler i material, ", sa DeForest. "Det öppnar dörren till många spännande tillämpningar inom vävnadsteknik och terapeutisk forskning."