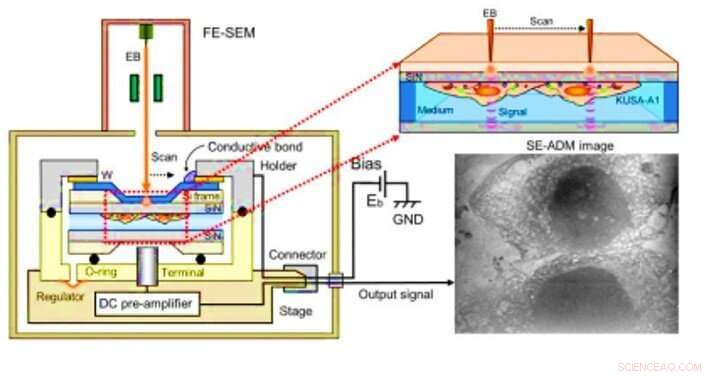
Svepelektronassisterad dielektrisk mikroskopi (SE-ADM) observation av osteoblaster. (A) Högupplöst SE-ADM inrättat för osteoblastobservation. Hållare för vätskeprov inklusive osteoblaster är monterad på förförstärkarens fäste, som införs i provets SEM-kammare. Svepelektronstrålen appliceras på den W-belagda SiN-filmen vid en låg accelerationsspänning. Mätterminalen under hållaren känner av elektriska signaler genom flytande prover. Tydliga intracellulära strukturer är synliga (höger bild). Kredit:Science Advances, doi:10.1126/sciadv.aax0672
Mineralisering förmedlas av osteoblaster, som utsöndrar mineralprekursorer genom matrisvesikler (MV) som en grundläggande process hos ryggradsdjur. Vesiklerna är kalcium- och fosfatrika, innehållande organiska material såsom sura proteiner. I en ny studie som nu publiceras i Vetenskapens framsteg , Tomoaki Iwayama och kollegor vid avdelningarna för parodontologi, biomedicinsk forskning, muntlig vetenskap, utveckling av biomaterial och oral anatomi använde svepelektronassisterad dielektrisk mikroskopi (SE-ADM) och superupplösningsmikroskopi (SRM) för att bedöma levande osteoblaster under mineraliseringsförhållanden vid upplösning på nanonivå. De fann att de kalciuminnehållande vesiklerna var multi-vesikulära kroppar som innehåller mineraliserande nanovesiklar eller matrisvesiklar (MV). Enligt iakttagelserna, MVs kunde transporteras tillsammans med lysosomer och utsöndras genom exocytos. Iwayama et al. presenterade bevis på att lysosomerna kunde transportera amorft kalciumfosfat i mineraliserande osteoblastceller.
Under den fysiologiska processen för benmineralisering, avsättningen av kalciumfosfatkristaller sker i den extracellulära matrisen som en grundläggande process hos alla ryggradsdjur. 1967, biologerna Clarke Anderson och Ermanno Bonucci, individuellt visualiserade mineralrelaterade partiklar i det extracellulära utrymmet med hjälp av elektronmikroskopi (EM). Forskare erkände senare dessa partiklar som mineraliserande nanovesiklar eller matrisvesiklar (MV). Under de senaste 50 åren av EM-studier på MV, biologer har kämpat för att förstå mekanismen för MV-bildning och utsöndring, som förblir i stort sett okänd.
Att klargöra mineraliseringsprocessen för levande celler med EM är utmanande eftersom provberedningen för EM kräver steg på både kemisk fixering och alkoholisk dehydrering. Stegen kan inducera artefakter och till och med lösa upp eller ta bort instabila mineralprekursorer som lämnar en organisk ställning som kallas ett "kristallspöke". Medan forskare framgångsrikt hade använt EM-processen med fixerad och uttorkad vävnad för att se strukturen av mineraliserade kollagenfibriller i ben, att studera mineralprekursorer, de måste använda kryo-EM-processer för att undvika uttorkning och underlätta kostsamma, extremt snabb kylning med små exemplar.
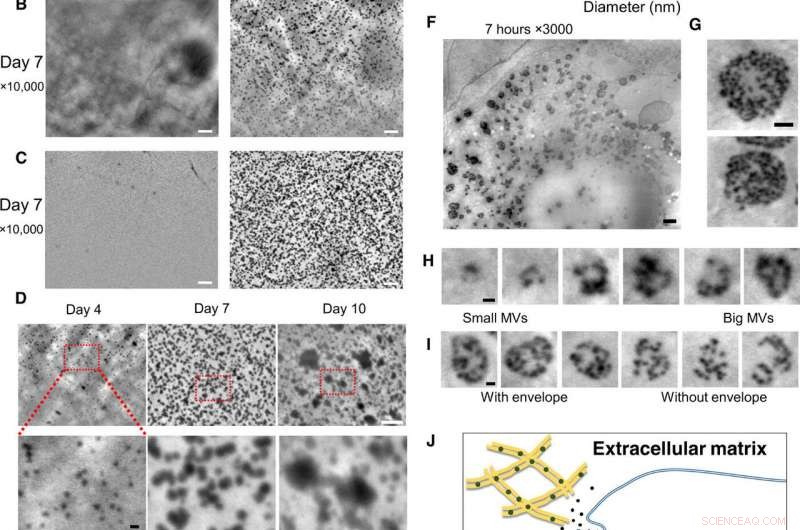
Nanoskalig observation av levande osteoblaster i kulturmedier, med SE-ADM-systemet. (A) Representativa högupplösta SE-ADM-bilder av osteoblaster odlade med eller utan osteogena medier i 2 dagar. Svarta partiklar var uppenbara endast när de odlades i osteogena medier (höger, kvadrat i botten). (B) Representativa högupplösta SE-ADM-bilder av osteoblaster odlade med eller utan osteogena medier i 7 dagar. Det finns många svarta partiklar när de odlas i osteogena medier (höger). (C) Representativa högupplösta SE-ADM-bilder av SiN-filmen efter cellavlägsnande. I vanliga medier, inga partiklar observeras (vänster). Bilden av filmen efter avlägsnande av celler odlade i osteogena medier visar många klara svarta partiklar utspridda i hela området (höger). (D) Jämförelse av partikelbilder under 4 till 10 dagars odling i osteogena medier. Partikelstorlekarna ökade gradvis. (E) Fördelning av partikelstorlek uppmätt under 4 till 10 dagars odling i osteogena medier. Ungefär 900 till 1100 partiklar per tidpunkt mättes och plottades som ett histogram. (F) Representativa högupplösta SE-ADM-bilder av osteoblaster odlade med osteogena medier i 7 timmar. (G) MVB:er har genomskinliga gråa kuvert. (H) Klipp ut bilder av olika MVB-storlekar, inklusive partiklar. (I) Jämförelse av MVB:er med eller utan ett grått kuvert. (J) Schematisk bild av intracellulär bildning och transport av MVB i mineraliserande osteoblaster. Skala staplar, 1 μm i (A) till (C) och (F); 500 nm in (G); 200 nm in (D, botten), (H), och jag). Kredit:Science Advances, doi:10.1126/sciadv.aax0672
För att övervinna dessa begränsningar i detta arbete, Iwayama et al. använde ett nytt mikroskopiskt system känt som svepelektronassisterad dielektrisk mikroskopi (SE-ADM). Metoden hade tidigare uppnått nanoskalaupplösning och högkontrastavbildning för däggdjursceller i vattenhaltiga medier utan färgning. Forskarna använde samma teknik (högupplöst SE-ADM) för att undersöka möjligheten att se MV i intakta osteoblaster för att förstå biogenes av MV-handel. För osteoblastcellinjen använde de murin (mus) osteoblastcellinje KUSA-A1, med hög osteogen kapacitet in vitro och in vivo. Efter cellodling under lämpliga förhållanden, Iwayama et al. observerade cellerna med SE-ADM för att identifiera normala intracellulära strukturer. Forskarna observerade att MV:er anpassade sig till kollagenfibriller efter 4 till 10 dagars celltillväxt i osteogena medier och den utsöndrade partikelstorleken ökade på grund av fusion eller partikeltillväxt, med sina storlekar som överensstämmer med tidigare rapporter för att antyda att de verkligen var MVs.
Vid ytterligare undersökning med SE-ADM, de noterade involveringen av den lysosomala vägen för att transportera och utsöndra intraluminala MV i en liknande process som exosomer. Intressant, både exosomer och MVs kategoriseras som extracellulära vesiklar med liknande storlekar; de utsöndras båda av osteoblaster och har delade funktioner under cell-cellkommunikation.

Karakterisering av mineralinnehållande vesiklar. (A och B) Högupplösta partikelbilder före (A) och efter (B) avlägsnande av celler odlade i osteogena medier i 7 dagar. Pseudofärgkartor över förstorade partikelbilder indikerade med röda pilar visas på höger sida av (B). Partiklar visar mycket jämna strukturer utan kristaller. (C) Svepelektronmikroskopi (SEM) bilder och EDX-spektrometrisk analys av partiklar på en SiN-film. SEM-bilden på vänster sida uppvisar SiN-filmen efter avlägsnande av celler odlade i normala medier, som inte visar några partiklar, och EDX-spektrometriska data visar inga toppar av fosfor och kalcium. I kontrast, SEM-bilden och EDX-spektrometriska data på höger sida visar partiklar och skarpa toppar av fosfor och kalcium efter odling i osteogena medier. (D) Analys av partikelelement med hjälp av EDX-spektrometriska kartor. Partiklar innehöll fosfor, kalcium, kol, och kväve. (E) Ramanspektra erhållna från osteoblaster odlade med eller utan osteogena medier under 23 dagar. En skarp topp på 960 cm−1 var uppenbar endast i osteogena medier (höger sida). a.u., godtyckliga enheter. (F) Jämförelse av SE-ADM-bilder av Alpl knockout (KO) osteoblaster i normala och osteogena medier. Partiklar försvann helt i osteogena medier. (G) EDX-spektrum av partiklar från Alpl KO-osteoblaster på en SiN-film. EDX-spektrometriska data på vänster sida uppvisar SiN-filmen efter avlägsnande av celler odlade i normala medier, som inte visar några toppar av fosfor och kalcium. Dessutom, partiklar i osteogena medier av högra data visar inga toppar i fosfor och kalcium. Skala staplar, 1 μm i (A), (C, topp), (D), och (F); 200 nm i (B); 100 nm in (B, höger). Kredit:Science Advances, doi:10.1126/sciadv.aax0672
I nästa steg, Iwayama et al. undersökt om dessa partiklar var MV innehållande kalcium och/eller fosfat. För detta, de odlade cellerna i osteogena medier under 7 dagar och observerade dem med SE-ADM för att registrera mycket släta strukturer utan kristallfacetter. Detta antydde att MVs inte kristalliserade utan förblev amorfa som också registrerats i en tidigare studie. När forskarna undersökte MV på en SiN-film (kiselmononitrid), de observerade skarpa toppar motsvarande fosfor, kalcium, kol och syreelement. De bekräftade fynden med Raman-spektroskopi för att visa närvaron av kalciumfosfat i MV.
Forskarna undersökte också effekterna av hypofosfatasi, ett medicinskt tillstånd kodat av Alpl (alkaliskt fosfatas) gen , varvid osteoblaster inte genomgår mineralisering in vitro. För detta, de redigerade genomet av osteoblastceller med hjälp av CRISPR-Cas9-genomredigeringsteknologin för att generera Alpl knockout-osteoblastkloner. När Iwayama et al. undersökte knockout-klonerna med högupplöst SE-ADM, de observerade inte MV, vilket ytterligare bekräftades med spektrometrisk analys på grund av frånvaron av fosfor- och kalciumtoppar.
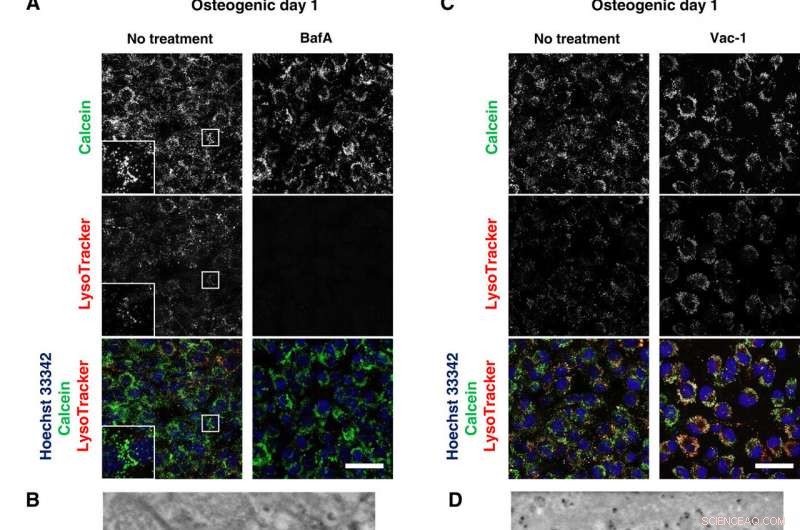
Lysosomala hämmare blockerar mineralisering. (A och C) Konfokal levande avbildning av 50 nM BafA- eller 10 μM Vac-1-behandlade osteoblaster. Celler odlades i osteogena medier innehållande BafA eller Vac-1 och färgades med Hoechst 33342 och LysoTracker Insättningar visar högre förstoring och inramad yta av varje kanal. (B och D) SD-ADM-bilder av BafA- eller Vac-1-behandlade osteoblaster. Celler odlades i osteogena medier innehållande BafA eller Vac-1. (E) Alizain Red S-färgning utförd utan fixering. Celler odlades i osteogena medier innehållande BafA eller Vac-1 och färgades med Alizain Red S. Representativa konfokala bilder. Skala staplar, 50 μm i (A), (C), och (E); 2 μm (B) och (D). Kredit:Science Advances, doi:10.1126/sciadv.aax0672
Efter att direkt observera produktionen och utsöndringen av MV med SE-ADM, forskarna undersökte vidare inblandningen av lysosomer i intracellulär handel med MV för att observera levande osteoblastmineralisering. De odlade cellerna i kalciuminnehållande osteogena medier och färgade dem med LysoTracker för att detektera de intracellulära komponenterna av intresse. Iwayama et al. lokaliserade de kalceinuppfyllda vesiklarna matchade med lysosomer för att antyda biogenes av MV inom lysosomer efter deras fusion med kalcein + vesiklar. Forskarna följde experimenten med studier av funktionsförlust och funktionell hämning för att ytterligare dekonstruera vägarna och undersöka intracellulära verkningsmekanismer under mineralisering av levande celler in vitro.
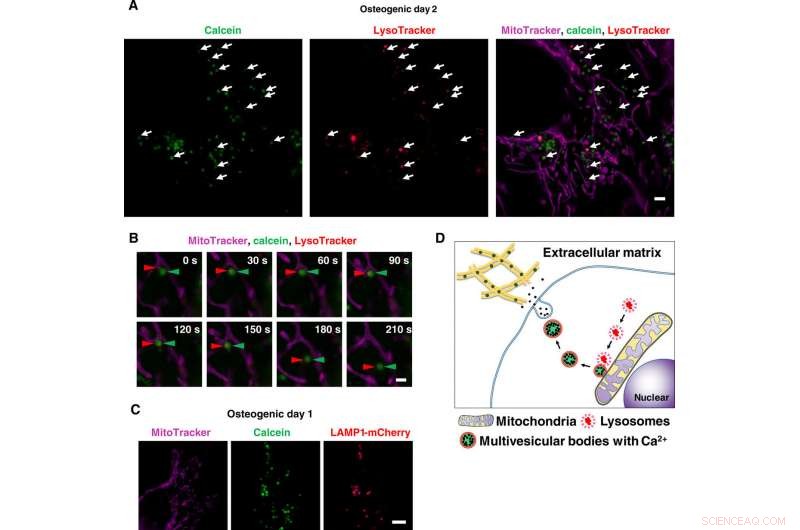
Superupplösning levande avbildning av kalciuminnehållande vesikeltransporter via lysosomer. (A) Ögonblicksbild av time-lapse SRM-bilder av kalceinmärkta osteoblaster. Celler odlades med kalcein och färgades med Lysotracker och MitoTracker. Vita pilar indikerar samlokalisering av lysosomer och kalceinpositiva vesiklar. (B) Närbild av time-lapse SRM-bilder av kalceinmärkta osteoblaster. Röda pilspetsar indikerar lysosom, och gröna pilspetsar indikerar kalcein. När lysosomer väl smält till kalceinpositiva vesiklar intill mitokondrier, de började röra sig mot det extracellulära rymden. (C) Representativ SRM-bild av LAMP1-mCherry-uttryckande celler. Celler transfekterades med LAMP1-mCherry-plasmid, odlad med kalcein, and stained with MitoTracker. Calcein-positive vesicles matched to LAMP1-mCherry–positive lysosomes. (D) Schematic view of lysosomal involvement in transportation of calcium in mineralizing osteoblasts. Skala staplar, 2 μm in (A), 1 μm in (B), and 10 μm in (C). Kredit:Science Advances, doi:10.1126/sciadv.aax0672
Scientists had previously reported the involvement of mitochondria during mineralization due to the presence of electron-dense calcium and phosphorous-rich granules in osteoblast mitochondria. This was observed with a modified cryotechnique. Vidare, reports also suggest the direct contact of lysosomes and mitochondria with functional significance. When Iwayama et al. stained cells with LysoTracker together with MitoTracker and observed the intracellular components under N-SIM structured illumination super-resolution microscopy (SRM). They observed the presence of most calcein-fulfilled vesicles next to mitochondria and matched with lysosomes. During SRM-time lapse imaging, the scientists further obtained views of intracellular transport of LysoTracker containing vesicles fused to static calcein vacuoles adjacent to mitochondria to validate their hypothesis.
På det här sättet, together with observations of other SRM systems and additional cell lines, Tomoaki Iwayama and colleagues proposed a mineralization mechanism. Wherein lysosomes played a central role in intracellular MV biogenesis and trafficking within osteoblasts. It was reasonable to involve lysosomes for osteoblasts to transport amorphous calcium phosphate without crystallization during its transport in the cytosol. The scientists aim to conduct further experiments to understand the regulatory molecules for MVs and investigate if MVs and exosomes have similar constitutions and mechanism underlying their generation, secretion and function. The SE-ADM strategy used in the present work can be installed into existing scanning electron microscopy apparatus at a low cost. The work developed in the study will offer non-invasive, high-resolution imaging at the nanoscale applicable to all scientific fields.
© 2019 Science X Network