Forskning nyligen publicerad i Naturkommunikation undersöker kapaciteten hos ett humant protein som hämmar HIV-1, APOBEC3G (A3G). Tidningen belyser arbetet av professor i Nordostfysik och ordförande Mark Williams, postdoktor Mike Morse, Professor Linda Chelico, University of Saskatchewan i Kanada, och Ioulia Rouzina, Ohio State University. Upphovsman:Mike Morse/Northeastern University
För femton år sedan, en klass proteiner upptäcktes, som ger människor medfödd immunitet mot HIV-1. Tyvärr, HIV-1 är ett smart virus och har utvecklats för att bekämpa dessa proteiner. Nordöstra forskare, med hjälp av sina medarbetare, har studerat dessa proteiner i flera år för att ytterligare förstå deras funktion och mekanismer i hopp om att bli bättre förberedda mot HIV-1.
Forskningen, publicerad i Naturkommunikation , lyfter fram arbetet av professor och ordförande i nordöstra fysik, Mark Williams, postdoktor Mike Morse, Professor Linda Chelico, University of Saskatchewan i Kanada, och Ioulia Rouzina, Ohio State University. Artikeln undersöker kapaciteten hos ett humant protein som hämmar HIV-1, APOBEC3G (A3G).
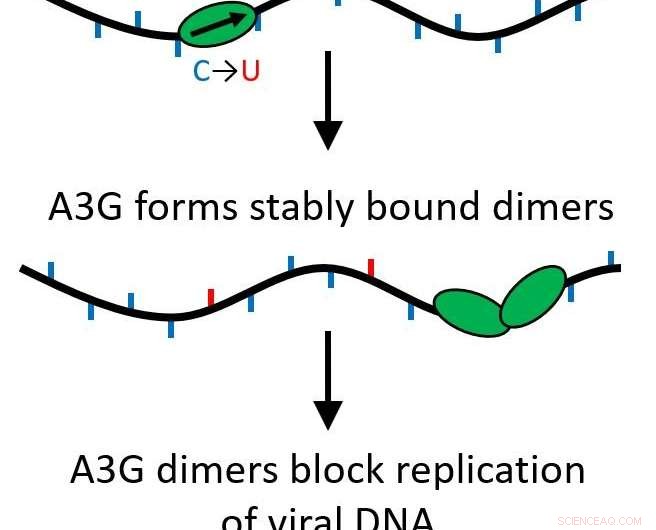
Deras resultat bestämde att när A3G-proteinet växer från ett enda protein (monomer) till ett tvåproteinkomplex (dimer), dess funktion omvandlas från att vara ett redigeringsprotein som muterar viralt DNA till att fungera som en vägspärr för ytterligare replikering av viruset.
"Jag blev helt förvånad över resultatet att dimerer var tillräckliga för att göra detta, "sa Williams." Vi har våra uppgifter, och uppgifterna berättade detta för oss, men det tog lång tid att inse att det enda sättet att förstå dessa data är att dimerer måste vara modellen för att proteinets egenskaper plötsligt ska förändras. "
Williams Laboratory for Single Molecule Biophysics specialiserar sig på instrument som kallas optiska pincetter som studerar molekyler som enkla DNA-molekyler eller DNA-proteinkomplex. Detta verktyg håller DNA eller RNA mellan två polystyrenpärlor för att titta på interaktioner med DNA genom att observera förändringar i dess längd och spänning. Med denna teknik, labbet studerar många olika biologiska system inklusive HIV-1-replikation. En kombination av dessa biofysiska metoder med enzymaktivitetsexperiment och skapande av mutanta former av A3G av Chelico -labbet gjorde det möjligt för Williams och Morse att jämföra den ursprungliga formen av proteinet med olika mutanter som innehåller strukturförändringar. Detta möjliggjorde isolering av processen som resulterade i stabilt bundet dimeriserat protein.
Under de senaste 12 åren har Williams lab har studerat HIV-1-replikering med hjälp av ett NIH-bidrag. Deras senaste projekt innebär att förstå de medfödda immunproteinerna som ger människor immunitet mot HIV-1. Det finns sju proteiner i APOBEC3 -familjen, varav några bekämpar retrovirus som HIV-1, medan andra kämpar mot retrotransposoner, som är genetiska element som förstärker sig inom ett genom och har potential att orsaka sjukdom.
Alla APOBEC -proteiner är cytidindeaminaser, låta dem modifiera enkelsträngat DNA för att ersätta baser, orsakar mutationer när strängen replikeras. Dock, A3G har också en annan funktion som gör tvärtom. Istället för att snabbt zippa längs genomet som gör ändringar, det kan bli ett stabilt bindande protein som förhindrar att omvänd transkription sker, förhindra HIV-1-replikation. Detta händer på grund av en process som kallas oligomerisering, där enskilda proteinenheter (monomerer) går samman för att skapa komplex eller oligomerer med flera proteiner.
"Tanken att du kan zooma längs och göra dessa förändringar, och ändå blockera något annat från att röra sig, var inte riktigt vettigt, "sade Williams." Det är därför oligomeriseringen är så viktig. När de börjar snabbt och går vidare, med tiden oligomeriseras de och blir väldigt långsamma. "
Detta forskargrupp upptäckte oligomeriseringen som publicerades i deras papper från 2014 Naturkemi . Deras studie visade att tillväxten av ett multiproteinkomplex fick proteinet att bromsa, men det var inte känt hur många proteiner som krävdes för att göra ett långsamt komplex. Om antalet var högt, resultaten kanske inte är relevanta för viral replikation. Dessutom, de kunde visa att komplexen var långsamma, men de kunde inte avgöra om de långsamma komplexen hade enzymaktivitet. Men nu har deras nya forskning funnit svaren på dessa två kritiska frågor.
"Mellan våra experiment där vi direkt observerade bindningen av proteiner till DNA, och professor Chelicos arbete med att undersöka den enzymatiska aktiviteten hos A3G, fann vi att på korta tidsskalor i den monomera formen, proteinet binder och dissocierar mycket snabbt från DNA och har hög enzymatisk aktivitet, "sa Morse." Men när du väl låtit den bilda dessa oligomerer, bindningen är mycket mer stabil, och dissocierar inte lika lätt. Professor Chelico kunde upptäcka att den enzymatiska aktiviteten faktiskt minskar när denna process inträffar så att du har dessa två funktioner - den enzymatiska aktiviteten som sker på engångsskala, och i en form, och denna sekundära funktion som, på grund av oligomeriseringen, sker på en annan tidsplan. "
Deras forskning visade att detta händer även om bara två proteiner kommer ihop, bildar en dimer. Dimeren räcker för att göra proteinkomplexet stabilt och förändra proteinets funktion. Eftersom det bara behövs en dimer, flera vägspärrar kan agera för att förhindra omvänd transkription. Nu, denna viktiga funktion är mer sannolikt biologiskt relevant.
"Att veta hur något hämmar HIV-1 kan vara en vägledning för att hjälpa till att designa nya metoder för anti-HIV-läkemedel. HIV-1-viruset har utvecklat sitt eget protein för att lura cellen till nedbrytande APOBEC-proteiner, så om vi kan ta reda på hur vi kan stoppa den nedbrytningen, kanske skulle vi kunna förbättra detta proteins förmåga att hämma HIV-1, "Sa Williams.
Williams Lab vid Northeastern University planerar att fortsätta studera de olika APOBEC -proteinerna, andra hämmar HIV-1 eller retrotransposoner. Genom att studera dessa proteiner med sina unika biofysiska mätverktyg, deras labb hoppas kunna förstå proteineregleringen, aktivitet, och processer som hjälper oss att vara vidare förberedda mot hiv och andra relaterade sjukdomar.