
Kredit:Elena Khavina/MIPT
Forskare från Moskvas institut för fysik och teknologi har publicerat en recension om seriell femtosekundkristallografi, en av de mest lovande metoderna för att analysera den tertiära strukturen hos proteiner. Denna teknik har utvecklats snabbt under det senaste decenniet, öppnar nya möjligheter för rationell design av läkemedel inriktade på proteiner som tidigare inte var tillgängliga för strukturanalys. Artikeln kom ut i tidningen Expertutlåtande om drogupptäckt .
Röntgenkristallografi
Röntgenkristallografi är en av de viktigaste metoderna för att avslöja 3D-strukturen hos biologiska makromolekyler, såsom proteiner. Det har hjälpt till att bestämma strukturen hos många farmakologiskt viktiga enzymer och receptorer, möjliggör design av läkemedel som riktar sig mot dessa proteiner.
Metoden går ut på att kristallisera ett protein och studera det via röntgendiffraktion. Först isoleras och renas proteinet. Sedan torkar lösningsmedlet gradvis ut. Som ett resultat, molekylerna vars struktur undersöks bildar kristaller, kännetecknas av en inre ordning. Genom att exponera en kristall för röntgenstrålar i en speciell enhet, forskare får ett diffraktionsmönster. Den innehåller information om atomernas positioner i kristallen. En noggrann analys av mönstret avslöjar 3D-strukturen hos de ingående proteinmolekylerna.
Före tillkomsten av denna metod, nya läkemedel söktes mest empiriskt:antingen genom att ändra strukturen hos de molekyler som är kända för att påverka målproteinet, eller genom att sortera genom arrayer av molekyler i kemiska bibliotek. Nu när 3D-strukturerna för många målproteiner är tillgängliga, forskare kan se dem på en datorskärm och snabbt sortera igenom miljontals substanser som söker efter läkemedelskandidater. På så sätt sparar de mycket tid och pengar som tidigare spenderats på kemisk syntes och "våta" experiment.
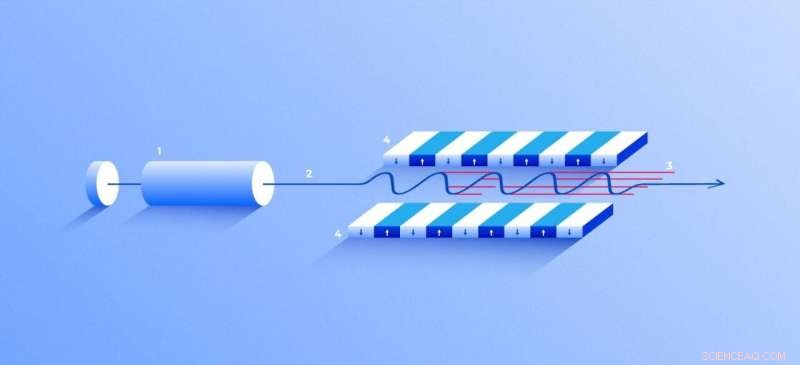
Röntgenfri-elektronlaser. En källa (1) avger fria elektroner (2) som rör sig bara tiotals gånger långsammare än ljusets hastighet genom undulatorn (4), en tunnel kantad med många magneter. Magnetfältet får en elektron som färdas genom tunneln att svänga och därför avger röntgenstrålar. Elektronernas rörelse i undulatorn är synkroniserad för att generera täta, högfrekventa röntgenpulser av anmärkningsvärd intensitet (3). Kredit:Elena Khavina/MIPT
Röntgenkristallografi ger bra resultat för kristaller som är stora, stabil, och homogen – det vill säga utan föroreningar eller strukturella defekter. För att bättre upptäcka en svag diffraktionssignal, en kraftfull strålningspuls behövs, men inte så kraftfull att den förstör kristallen. I konventionell röntgenkristallografi, en proteinkristall roteras i röntgenstrålen för att producera diffraktionsmönster för olika rumsliga orienteringar. Detta fångar maximal information om strukturen.
Metod för knepiga mål
Strax efter att röntgenkristallografi dök upp, det blev tydligt att inte alla biologiska makromolekyler kan kristalliseras. Vissa proteiner löses vanligtvis i det inre cellmediet. Så det är ganska lätt att lösa dem, förånga det, och få en stor vanlig kristall. Men membranproteiner, många receptorer bland dem, bildar kristaller som inte är tillräckligt stora och rena för vanlig röntgenkristallografi. Som sagt, många av dessa proteiner är involverade i sjukdomsutveckling, vilket innebär att deras struktur är av stort intresse för farmakologer.
För mindre än ett decennium sedan, en lösning hittades för membranproteiner. Denna nya teknik, kallad seriell femtosekund röntgenkristallografi, eller SFX, förlitar sig på röntgenfria elektronlasrar, utvecklades strax före SFX.
Alexey Mishin, biträdande chef för Laboratory for Structural Biology of Receptors vid MIPT, som var medförfattare till studien, förklarade:"Det som gör det till en banbrytande teknik är en mycket hög energitäthet hos laserpulsen. Objektet utsätts för så kraftig strålning att det faller isär, oundvikligt och nästan omedelbart. Men innan det gör det, vissa individuella kvanta av laserpulsen sprider sig från provet och hamnar vid detektorn. Detta är den så kallade diffraktion-före-destruktion-principen för att studera strukturen hos det ursprungliga proteinet."

Två sätt att mata in kristaller i enhetens arbetsområde:i en ström av vätska (3, vänster) och på ett fast underlag (3, höger). I båda fallen, röntgenstrålen (2) som passerar genom kristaller genererar ett diffraktionsmönster på skärmen (1). Kredit:Elena Khavina/MIPT
Röntgenfria elektronlasrar har visat sig användbara utanför biologin:Under de senaste åren, SFX har använts allt oftare av fysiker och kemister, för. Den första enheten blev tillgänglig för experimenterande 2009, och nu finns det fem centra öppna för forskare i USA, Japan, Sydkorea, Tyskland, och Schweiz. En ny byggs i Kina, och den amerikanska anläggningen – historiskt sett den första – har tillkännagett planer på modernisering.
Medan den nya tekniken har erbjudit forskare en inblick i strukturen hos proteiner som tidigare undvikit analys, det har också främjat nya tekniska och matematiska lösningar. Konventionell röntgenkristallografi innebär att en kristall exponeras för strålning från olika vinklar och att de resulterande diffraktionsmönstren analyseras kollektivt. I SFX, kristallen förstörs omedelbart av den första interaktionen med en kraftfull röntgenpuls. Så forskare måste upprepa processen med många små kristaller och analysera den "seriella" data som genereras på detta sätt, därav namnet på metoden.
En ytterligare utmaning är att välja ut proverna för SFX. I konventionell röntgenkristallografi, att helt enkelt välja den största kristallen av högsta kvalitet var vägen att gå. Detta kan göras manuellt, genom att titta på tillgängliga prover. Den nya proceduren kräver att man arbetar med en suspension av många små kristaller av varierande storlek och kvalitet. Centrifuger och filter med kända pordimensioner används för att separera kristallerna efter storlek.
Metoder för att placera prover i kammaren måste utvecklas, för. Röntgenfrielektronlasrar har en viss maximal frekvens vid vilken de kan avge strålningspulser. För att minska kostnaderna och tidsåtgången, nya kristaller bör matas in i kammaren med samma frekvens. Än så länge, två metoder har utvecklats för att göra detta. Under den första, kristallerna kommer in i kammaren i en flytande suspension, levereras av en injektor. Strålen som lämnar injektorn "kläms" av en gasström för att säkerställa korrekt provplacering. Det är, när man passerar, en kristall hamnar precis i mitten av laserstrålen (fig. 2, vänster). Alternativt proteinkristallerna kan spridas över ett substrat som är transparent för röntgenstrålar och automatiskt matas in i laserstrålen före varje puls (fig. 2, höger).
Sedan de producerade sina första resultat 2011, SFX har avslöjat över 200 proteinstrukturer. Bland dem finns 51 mål potentiellt viktiga för farmakologi - membranreceptorer, jäser, virala proteiner, etc — som tidigare var otillgängliga för konventionella analystekniker.
MIPT-teamets systematiska översyn av tekniken som tillämpas på biologi och farmakologi kommer utan tvekan att hjälpa andra forskare som försöker få strukturerna för viktiga läkemedelsmål för att utveckla nya mediciner.