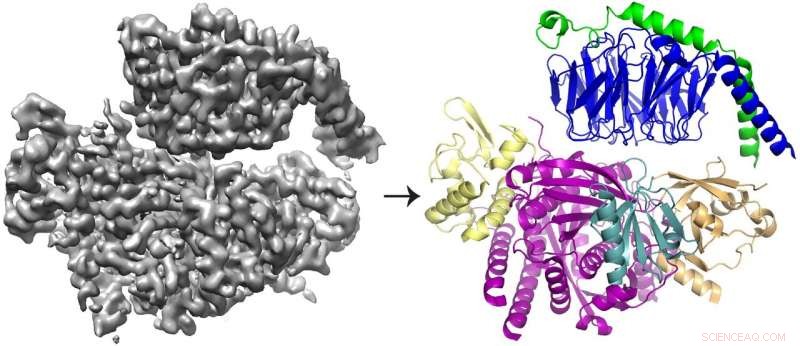
Kryo-EM 3D-rekonstruktionen (vänster) av proteinet P-Rex1 bundet till Gβγ och proteinmodellen (höger) visar att Gβγ (topp; blått och grönt) binder till en kompakt, flerdomänlig yta på P-Rex1 (botten; gul, magenta, kricka och guld). Upphovsman:Jennifer Cash, UM LifeSciences Institute.
När celler i våra kroppar måste röra sig - för att attackera en infektion eller läka ett sår, till exempel — cellulära proteiner skickar och tar emot en kaskad av signaler som leder cellerna till rätt plats vid rätt tidpunkt. Det är en process cancerceller kan kapa för att spridas till nya vävnader och organ.
Nu, ett team av forskare som leds av University of Michigan Life Sciences Institute har belyst en viktig drivkraft för denna process. Resultaten, planerad att publicera 16 oktober Vetenskapliga framsteg , erbjuda viktiga insikter om cellmigration inte bara under normala hälsoförhållanden, men också i bröstet, prostata och andra typer av cancer.
Forskarna undersökte specifikt ett protein som heter P-Rex1 (fosfatidylinositol 3, 4, 5-trifosfatberoende Rac-växlare 1), som aktiveras när det binder ett annat protein, Gbg. Trots upptäckten av P-Rex1 för mer än 15 år sedan, exakt hur de två proteinerna interagerar och hur denna interaktion leder till cellrörelse har förblivit dåligt förstått.
Med hjälp av en kombination av strukturbiologi och biokemitekniker, forskarna har avslöjat strukturen för P-Rex1 bunden till Gbg, ger en ögonblicksbild av hur denna invecklade aktiveringsprocess utvecklas.
"Att veta strukturen i detta proteinkomplex ger mekanistiska detaljer som gör att vi kan förstå hur det regleras, "sa Jennifer Cash, LSI -forskare och huvudförfattare till studien. "Och när vi förstår hur det regleras, vi kan börja tänka på hur vi kan ändra den regleringen och hämma P-Rex1-signalering vid cancer. "
Teamet fann att Gbg binder till en omfattande yta på P-Rex1 som består av flera olika proteindomäner. Tidigare studier erbjöd motstridiga argument om vilken domän (eller domäner) som band Gbg. Men denna senaste studie kunde lösa konflikten genom att ta en större bild av proteinet, använder nyare teknik.
"Vi ville titta på enzymet som helhet - och för att göra det, vi behövde verkligen flytta in i cryo-EM, "sa John Tesmer, professor i biologisk vetenskap vid Purdue University och en av studiens ledande författare.
Cryo-EM, eller kryo-elektronmikroskopi, gör det möjligt för forskare att studera proteiner som inte kan visualiseras med andra strukturbiologiska tekniker - såsom komplexet, sammanvävd struktur av P-Rex1. Processen innebär att man fryser proteiner i ett tunt lager vatten och sedan använder elektroner för att fånga bilder av deras form. Hundratusentals bilder räknas sedan i genomsnitt för att skapa en 3D-struktur.
Utöver att klargöra hur Gbg binder till och aktiverar P-Rex1, dessa nya fynd står som en viktig prövsten i utvecklingen av cryo-EM, sa Michael Cianfrocco, LSI biträdande professor och seniorförfattare till studien.
Majoriteten av strukturerna som bestäms med cryo-EM är större, symmetriska molekyler. Resultaten för P-Rex1, i kontrast, representerar en högupplöst struktur av det minsta asymmetriska proteinet som hittills har uppnåtts genom cryo-EM. Vidare, en stor domän i P-Rex1 har en struktur eller veck som inte tidigare hade identifierats i något annat däggdjursprotein, kräver att laget bygger det bit för bit-en svår uppgift med cryo-EM-data.
"Cryo-EM är fortfarande ett relativt nytt område, och människor är verkligen intresserade av att veta hur långt dess gränser kan skjutas, sa Cianfrocco, som också är biträdande professor i biologisk kemi vid U-M Medical School.
Science Advances-papper har titeln "Kryo-elektronmikroskopistruktur och analys av P-Rex1-Gbg-signalställningen."